Phosphoglyceratmutase
Phosphoglyceratmutasen (PGAM) sind Enzyme, die die Umlagerung der Phosphatgruppe in Phosphoglycerat von 2- auf 3-Position und umgekehrt katalysieren. Diese Reaktion ist ein Teilschritt in der Glycolyse, der Verwertung von Kohlenhydraten im Stoffwechsel aller Lebewesen, die in jeder Zelle stattfindet. Mit den Säugetieren haben sich durch Kopie zusätzliche Allele des PGAM1-Gens gebildet, die PGAM2, PGAM4 und PGAM5 genannt werden. PGAM2 wird nur in den Muskeln produziert. Mutationen am PGAM2-Gen führen zu einer Form der Muskeldystrophie.
| Phosphoglyceratmutase | ||
|---|---|---|
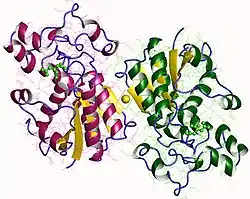 | ||
| Phosphoglyceratmutase 1 (B type) dimer (Mensch) nach PDB 1YFK | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 253/252/254/270 Aminosäuren | |
| Sekundär- bis Quartärstruktur | Homodimer | |
| Bezeichner | ||
| Gen-Namen | PGAM1 ; PGAM2; PGAM4; PGAM5 | |
| Enzymklassifikation | ||
| EC, Kategorie | 5.4.2.1, Isomerase | |
| Reaktionsart | Umlagerung | |
| Substrat | 2-Phosphoglycerat | |
| Produkte | 3-Phosphoglycerat | |
| Vorkommen | ||
| Übergeordnetes Taxon | Lebewesen | |
Katalysierte Reaktion
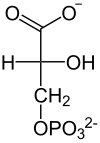 ⇔
⇔ 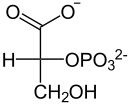
2-Phosphoglycerat wird umgelagert zu 3-Phosphoglycerat und umgekehrt. Die Katalyse erfolgt durch zwischenzeitliche Bildung eines Phosphohistidin-Restes in der PGAM. Dabei ist zu beachten, dass ein zusätzlicher Phosphatrest an C2 angelagert wird und somit das Zwischenprodukt 2,3-BPG entsteht.
Erst danach wird der Phosphatrest an C3 entfernt und die Mutase erhält die Phosphorylgruppe zurück, um den Phosphohistidin-Rest zu regenerieren.
Das Enzym benötigt katalytische Mengen an 2,3-Bisphosphoglycerat, um den Histidinrest im aktiven Zentrum in phosphorylierter Form zu halten.[1]
Weitere Funktionen
Die PGAM-Isoformen haben zusätzlich schwache Aktivität als Bisphosphoglyceratmutase (EC 5.4.2.4) und als Biphosphoglycerat-Phosphatase (EC 3.1.3.13).
PGAM1 wird in Krebszellen im Übermaß produziert. PGAM1 bindet in vitro am Kern von Hepatitis-C-Virus. Patienten mit autoimmuner Hepatitis erzeugen vermehrt PGAM1-Antikörper.[2][3][4]
PGAM5 wird an die Außenmembran von Mitochondrien transportiert und bindet dort Keap1 und Nrf2.[5]
Weblinks
Einzelnachweise
- Jeremy M. Berg, John L. Tymoczko, Lubert Stryer, Gregory J. Gatto jr.: Stryer Biochemie. Springer-Verlag, 2014, ISBN 978-3-8274-2988-9, S. 467 (eingeschränkte Vorschau in der Google-Buchsuche).
- F. Lu et al.: Serum proteomic-based analysis for the identification of a potential serological marker for autoimmune hepatitis. Biochem Biophys Res Commun. 367/2/2008:284-90. PMID 18154727
- H. X. Su et al.: Screening cellular proteins binding to the core region of hepatitis C virus RNA genome with digoxin-labeled nucleic acids. Intervirology. 50/4/2007:303-9. PMID 17622790
- L. J. Huang et al.: Proteomic analysis of secreted proteins of non-small cell lung cancer. Ai Zheng. 25/11/2006:1361-7. PMID 17094902
- S. C. Lo und M. Hannink: PGAM5 tethers a ternary complex containing Keap1 and Nrf2 to mitochondria. Exp Cell Res. 314/8/2008:1789-803. PMID 18387606