Pharmalogistik
Pharmalogistik umfasst alle logistischen Prozesse, die durch die speziellen Anforderungen an Arzneimittel entstehen.

Aus den speziellen Vorschriften und Gesetzen ergibt sich, dass das primäre Ziel – im Gegensatz zur konventionellen Logistik – nicht nur die Effizienz aller logistischen Prozesse ist, sondern in besonderem Maße deren Transparenz, Zuverlässigkeit und Regelkonformität. Das hat zur Konsequenz, dass der logistische Auftrag der Sechs-R-Regel der Logistik weiterhin gilt, aber unter diesen Bedingungen interpretiert werden muss.
Bedeutung
Die Pharmalogistik ist ein spezielles Teilgebiet der Logistik und umfasst grundsätzlich alle logistischen Prozesse der Pharmaindustrie und der nachgeordneten Distributoren. Dadurch wird die Verfügbarkeit von Arzneimitteln und der Wirk- und Einsatzstoffe, die für die Herstellung dieser Arzneimittel benötigt werden, entlang der gesamten Lieferkette sichergestellt. Die Verfügbarkeit von Arzneimitteln basiert auf Beschaffungs- und Vertriebsstrategien der Marktteilnehmer wie Pharmaunternehmen, Großhändler und Apotheken.
Arzneimittel sind gemäß § 2 AMG folgende Stoffe oder Zubereitungen aus Stoffen:
- die zur Anwendung im oder am menschlichen Körper bestimmt sind und als Mittel mit Eigenschaften zur Heilung oder Linderung oder zur Verhütung von Krankheiten oder krankhafter Beschwerden bestimmt sind oder
- die im oder am menschlichen Körper angewendet oder einem Menschen verabreicht werden können, um entweder a. die physiologischen Funktionen durch eine pharmakologische, immunologische oder metabolische Wirkung wiederherzustellen, zu korrigieren oder zu beeinflussen oder b. eine medizinische Diagnose zu erstellen.
Aufgrund der speziellen und komplexen Handhabung und den zum Teil sehr unterschiedlichen chemischen und physikalischen Eigenschaften von Arzneimitteln bedarf die Pharmalogistik strikter Regularien. Lagerhaltung, Transport und Umschlag unterliegen Regeln, die Unternehmen zwingend umsetzen müssen, um gleichermaßen die Arzneimittelqualität und die Umwelt zu schützen. Dies bedarf individueller und kontrollierbarer Prozesse und Strukturen.
Neben der Differenzierung von Pharmazeutika nach chemischen und physikalischen Eigenschaften lassen sich Arzneimittel auch auf Basis der gesetzlichen Vorgaben unterscheiden. Es wird zwischen rezeptpflichtigen (Rx), apothekenpflichtigen (OTC, von englisch over the counter ‚über die Ladentheke‘) und frei verkäuflichen Produkten unterschieden. Spezielle Regelungen gelten zusätzlich für Betäubungsmittel, kühl- und kühlkettenpflichtige Arzneimittel oder radioaktive Arzneimittel.
Die gesetzlichen Vorschriften sowie die spezielle Handhabung (Lagerung und Transport) wirken sich direkt auf die logistischen Prozesse aus und geben Rahmenbedingungen vor. Beispielsweise müssen Betäubungsmittel immer separat zu normalen Arzneimitteln in Wertschutzschränken aufbewahrt werden; bei kühlkettenpflichtigen Arzneimittel hingegen dürfen Temperaturtoleranzen nicht unter- oder überschritten werden.
Ziele der Pharmalogistik
Aus logistischer Perspektive lassen sich in der Pharmalogistik zwei Hauptziele definieren. Zum einen muss die Qualität der Arzneimittel über die gesamte Lieferkette (PharmaChain) sichergestellt werden. Zum anderen müssen logistische Prozesse abgewickelt werden, ohne dabei Gefahren für die Umwelt darzustellen. Um logistische Prozesse mit möglichst geringem Risiko standardisiert durchführen zu können, wurden in der Pharmabranche entsprechende Standardarbeitsanweisungen (engl.: Standard Operating Procedures, SOPs) eingeführt.
Um sowohl den Transport und die Lagerung optimal planen zu können, sind Pharma-Logistikfirmen oder Logistikabteilungen in Unternehmen darauf angewiesen genaue Informationen zu den Pharmazeutika abrufen zu können. Dazu müssen neue Artikel im System genau angelegt werden und mit der Pharmazentralnummer (PZN) verknüpft werden.
Von Unternehmen über die gesamte Lieferkette genutzte Systeme werden stets validiert und qualifiziert. Um eine lückenlose Qualifizierung garantieren zu können, setzt die Pharmaindustrie, beispielsweise bei der Qualifizierung von Lagern, auf das aus der IT-Branche bekannte V-Modell.
Branche
Allgemein befindet sich die Pharmaindustrie in einem konstanten Wachstum. Der weltweite Umsatz belief sich Anno 2016 auf 1,025 Mrd. Euro.[1] In Deutschland konnte 2017 ein Gesamtumsatz von 41,5 Mrd. Euro verzeichnet werden,[2] dies entspricht einem Wachstum von 5 Prozent. Auch die Beschäftigung stieg von 2010 bis 2016 um ca. 12,1 Prozent an.[3]
Laut einer Studie von Miebach Consulting zum Thema Pharmalogistik aus dem Jahr 2016 gelten für Partizipanten End-to-End-Visibility, Optimierung des Vertriebsnetzwerks und Verbesserung der Prognosegenauigkeit, verglichen mit den Studienergebnissen von 2012, zu den größten Herausforderungen der Pharmalogistik. Zusätzlich liegt der Fokus für Unternehmen aber auch auf der vollständigen Umsetzung von Sendungsverfolgung (Track & Trace), sowie der Unterbindung von Arzneimittelfälschungen durch Serialisierung.[4]
Die Hauptakteure in der Pharmabranche sind neben Pharmaherstellern, Großhändlern und Apotheken unter anderem Logistikdienstleister sowie Re- und Parallelimporteure.
Hersteller
Mit der Produktion und Vermarktung von Pharmazeutika stellen Pharmaunternehmen den Mittelpunkt des Pharmasektors dar. Allgemein kann die Gruppe der Hersteller weiter in forschende Hersteller (z. B. Novartis) und Generikahersteller (z. B. ratiopharm) unterschieden werden. Im Gegensatz zu forschenden Herstellern charakterisieren sich Generikahersteller dadurch, dass sie nur begrenzt in Forschung investieren und nach Ablauf von Patenten und Unterlagenschutz von forschenden Herstellern wirkstoffgleiche Arzneimittel produzieren. Pharmahersteller besitzen mit der Herstellungserlaubnis (nach Artikel 40, Abs. 1, der Richtlinie 2001/83/EG) zum Teil auch gleich die Erlaubnis, Arzneimittel zu vertreiben und damit Handel zu betreiben.
Apotheken
Apotheken bilden in der Pharma-Lieferkette die letzte Stufe vor der Ausgabe der Pharmazeutika an den Patienten. Angeboten werden neben Fertigarzneimitteln auch Rezepturen (Einzelanfertigungen) und Defekturen („Rezeptur im Voraus“) sowie apothekenübliche Waren. Die Belieferung der Apotheken erfolgt zum überwiegenden Großteil durch Pharmagroßhändler. Dies liegt besonders an der der Tatsache, dass Großhändler durch ausgezeichnete Vertriebsnetze in der Lage sind, kostengünstigere Transporte durchzuführen. Neben einem Grundbestand, der in Apotheken vorhanden sein muss, können Apotheken ihren Bedarf aufgrund der schnellen Lieferzeit durch die Großhändler im Allgemeinen gut planen. EDV-gestützte Lager in Apotheken sorgen dafür, dass Medikamente automatisch ein- und ausgelagert werden können und geben einen Überblick über niedrige Bestände. Aufgrund der in Deutschland vorherrschenden Distributionsstruktur mit Einbindung von Großhändlern rechnet sich der Direktbezug von Arzneimitteln bei den Herstellern in beinahe allen Fällen weder für die Apotheke noch für die Hersteller.
Präsenzapotheken
In Deutschland bieten die allermeisten Präsenzapotheken („stationäre Apotheken“, „Vor-Ort-Apotheken“) ihren Kunden an, nicht vorrätige Arzneimittel nach Hause zu liefern. Bei der Bestellabwicklung dieser Art arbeiten Apotheken mit Großhändlern eng zusammen. Bestellte Arzneimittel werden an die Apotheke geliefert und mit eigenen Fahrzeugen an die Patienten geliefert (sog. Boten).[5]
Mit der Bestellung über Internet und der Abholung in der Apotheke (Click & Collect), die viele Präsenzapotheken anbieten, sollen Servicekennzahlen von Apotheken optimiert werden. Durch die Einführung dieser, für Kunden durchaus praktischen, Alternative werden Kunden nach Absenden der Bestellung informiert, sobald der nachgefragte Artikel in die Apotheke geliefert wurde und zur Abholung bereit ist. Aus logistischer Sicht handelt es sich um eine sehr gute Alternative zu klassischen Versandapotheken im Internet, da die Last-Mile-Problematik durch die Selbstabholung der Kunden entfällt.
Versandapotheken
Seit 2004 ist in Deutschland der Versandhandel von Arzneimitteln erlaubt. Von den circa 20.000 Apotheken in Deutschland (Stand 2016) haben über 3.000 zusätzlich eine Versandhandelserlaubnis.[6] Sollten rezeptpflichtige Medikamente bestellt werden, muss zusätzlich das Rezept an die Versandapotheke gesendet werden.
Dadurch, dass Versandapotheken mit höheren Beständen rechnen, beziehen Versandapotheken ihre Arzneimittel in größerem Umfang von den Herstellern direkt. Für den Versand nutzen Versandapotheken die Netzwerke von KEP-Diensten wie etwa DHL und Hermes.
Die Belieferung kann alternativ zum Versand mittels KEP-Diensten über sogenannte Pick-up-Stellen (z. B. in Drogeriemärkten) erfolgen, an denen die Kunden und Patienten ihre Bestellungen abholen können.[7]
Großhändler
Mit der Zwischenschaltung von Großhändlern in die Vertriebsstruktur des Healthcare-Sektors ist es möglich, Apotheken und Krankenhäuser zuverlässig ein- bis dreimal täglich mit Arzneimitteln zu versorgen. Mit den Netzwerken der Großhändler sinkt die Direktversorgung der Apotheken durch die Hersteller. Die Transportaufwände sowie die damit verbundenen Kosten für Einzelhändler und Hersteller sinken dadurch. Hinzu kommt, dass Großhandelsstandorte untereinander Arzneimittel versenden können, die meistens am nächsten Tag in den nachfragenden Gebieten angeboten und ausgeliefert werden können. Durch die Abnahme größerer Mengen ist es Großhändlern möglich Rabatte weiterzugeben, die vom Hersteller angeboten werden, wovon sowohl Einzelhändler wie Apotheken, aber auch die Patienten, profitieren. Alle Großhändler sind gesetzlich dazu verpflichtet nach der „Guten Vertriebspraxis“ (GDP) zu handeln.
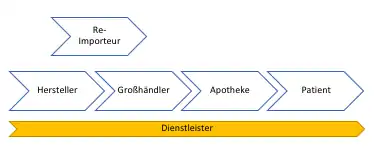
Import-Firmen
Über Re- und Parallelimporteure ist es Großhändlern möglich, Medikamente billiger zu beschaffen, als das im eigenen Markt möglich wäre. Ein Reimport liegt vor, wenn Pharmahersteller im Inland Arzneimittel für den Export-Markt produzieren und dort billiger absetzen. Die dort angebotenen Arzneimittel werden durch Reimport-Firmen aufgekauft, umgepackt und zurück nach Deutschland verkauft. Parallelimport bedeutet den Import von im EU-Ausland hergestellten und zugelassenen Arzneimitteln für den inländischen Markt durch ein weiteres Unternehmen zusätzlich zu dem (teureren) durch den Hersteller.[8] In Deutschland können solche Arzneimittel dann billiger angeboten werden als die gleichen Produkte, die im Inland beschafft werden.
Logistikdienstleister
Aufgrund der Komplexität und des Aufwands, der bei Transporten von Arzneimitteln und pharmazeutischen Produkten betrieben werden muss, werden Transportdienstleistungen fast nur noch von externen Transport- und Speditionsunternehmen erbracht. Allgemein gängig in der Transportdienstleisterbrache ist die Tatsache, dass Transportdienstleister aus verschiedenen Gründen selbst Subunternehmer für die Transporte einsetzen.
Als die wesentlichen Transportarten gelten im Inland und bei europaweiten Transporten LKW; bei interkontinentalem Transporten die See- und Luftfracht. Kritische Stellen bilden bei internationalen Transporten besonders der Wechsel der klimatischen Bedingungen, andere gesetzliche Auslegungen und Richtlinien, sowie Verzollungs- und Umschlagsprozesse.
Gesetzliche Vorschriften und Richtlinien
Aufgrund der Regulierung des Pharmamarktes durch den jeweiligen Gesetzgeber, müssen Unternehmen besondere Vorschriften bei Transport und Lagerung beachten.
Globale gesetzliche Richtlinien
Die WHO (World Health Organisation) erarbeitet in Zusammenhang mit den WHO Mitgliedsstaaten, nationalen Behörden, der partizipierenden Industrie und NGOs (Non-governmental organizations) die WHO-Richtlinien. Diese werden nach erfolgreicher Prüfung durch den Sachverständigenausschuss der WHO als internationale Normen angenommen. Die amerikanische Gesetzgebung sieht zusätzlich, ebenso wie die deutschen nationalen und europäischen Regelwerke, eine Überwachung der pharmazeutischen Betriebe vor. In den USA übernimmt die FDA (Food and Drug Administration) diese Rolle. In Deutschland sind die Länder für die Überwachung zuständig.
Um die Richtlinien auch im Bereich Luftfracht korrekt umzusetzen, wurde die IATA (International Air Transport Association) beauftragt, bei der Umsetzung zu helfen. Daraufhin wurde das CEIV (Center of Excellence for Independent Validators) gegründet. Das CEIV dient als Trainingszentrum für Partizipanten der Pharmabranche. Das CEIV Zertifikat ist international gültig und anerkannt und soll in einem zunehmend globalen Handel Einheitlichkeit schaffen, sowie Standards in Handhabung von Pharmaprodukten.[9]
Auf nationaler Ebene bilden Gesetze die höchste Ebene, wie in Deutschland das Arzneimittelgesetz (AMG). Mit dem Erlass von neuen EU-Direktiven (Richtlinien) durch die europäische Union sind die Richtlinien noch nicht wirksam und verpflichtend für Marktteilnehmer. Der Gesetzgeber ist verpflichtet die Richtlinien in nationales Recht umzusetzen. Im deutschen Recht erfolgt dies in Form von Gesetze oder Verordnungen. Die nächste Ebene in der Gesetzeshierarchie bilden Verordnungen, gefolgt von Verwaltungsvorschriften. Neben Gesetzen und Verordnungen gelten für Marktteilnehmer in der EU zusätzlich Leitlinien im Rahmen der „Guten Praktiken“ (GxP), besonders wichtig für die Pharmalogistik: GDP und GMP.
Die GDP-Guideline richtet sich vorwiegend an Großhändler, allgemein ist sie aber für alle Personen und Firmen verpflichtend, die Arzneimittel vertreiben und damit Handel betreiben. Der Inhalt der Guideline ist wie folgt gegliedert:[10]
- Kapitel 1 – Qualitätsmanagement
- Kapitel 2 – Personal
- Kapitel 3 – Räumlichkeiten und Ausstattung
- Kapitel 4 – Dokumentation
- Kapitel 5 – Operationen
- Kapitel 6 – Beschwerden, Rückrufe, Retouren
- Kapitel 7 – Ausgelagerte Tätigkeiten
- Kapitel 8 – Selbstinspektionen
- Kapitel 9 – Transport
Gesetze, Verordnungen und Richtlinien in Deutschland
- AMG: Arzneimittelgesetz
- AM-HandelsV: Arzneimittel-Handelsverordnung
- AMRadV: Verordnung über radioaktive oder mit ionisierenden Strahlen behandelnde Arzneimittel
- AMVerkRV: Verordnung über apothekenpflichtige und freiverkäufliche Arzneimittel
- AMVV: Arzneimittelverschreibungsverordnung
- AMWHV: Arzneimittel- und Wirkstoffherstellungsverordnung
- ANSG: Apothekennotdienstsicherstellungsgesetz
- AVWG: Arzneimittelversorgungs-Wirtschaftlichkeitsgesetz
- GMP-Leitlinie: Leitfaden für Gute Herstellungspraxis
- GDP-Leitlinie: Leitfaden für Gute Vertriebspraxis
- BtMG: Betäubungsmittelgesetz
- BtMAHV: Betäubungsmittel-Außenhandelsverordnung
- BtMBinHV: Betäubungsmittel-Binnenhandelsverordnung
- BtMVV: Betäubungsmittel-Verschreibungsverordnung
Kühlketten-Management
Die Gesetzgebung gibt Regelungen für den Transport und die Lagerung von kühlpflichtigen und kühlkettenpflichtigen Arzneimitteln vor. Hierbei gibt insbesondere die GMP-Richtlinie für Hersteller vor, wie Arzneimittel produziert und gehandhabt werden müssen, um die Qualität nicht nachhaltig zu beeinflussen. Die Qualitätskontrolle ist somit wichtiger Bestandteil bei Lagerung, Produktion und Transport und muss ausreichend von allen Beteiligten der Lieferkette dokumentiert und durchgeführt werden.
Allgemein werden Kühlketten in aktive und passive Kühlkette unterschieden. Kühlpflichtige Medikamente können sowohl aktiv als auch passiv gekühlt werden. Anders sind kühlkettenpflichtige Arzneimittel zu handhaben. Diese dürfen nicht passiv gekühlt werden. Bei kühlkettenpflichtigen Arzneimitteln ist stets darauf zu achten, dass die Kühlung durchgehend ist und ununterbrochen stattfindet.
Aktive Kühlkette
Durch die aktive Kühlkette wird das Ziel verfolgt, vorgeschriebene und definierte Temperaturintervalle von Arzneimittel durchgehend einzuhalten. Dabei wird neben der durchgehenden Kühlung auch eine durchgehende Temperaturkontrolle und -aufzeichnung durchgeführt. Aufgrund der Temperaturempfindlichkeit kühlkettenpflichtiger Arzneimittel, hat der Umschlag dieser Produkte und Waren höchste Priorität. Fahrzeuge, die für den Transport von kühlkettenpflichtigen Arzneimittel verwendet werden, müssen vor Einsatz qualifiziert und mit geeigneten Temperaturkontrollsystemen (Datenlogger) ausgestattet werden; gleiches gilt für Lagerbereiche.
Passive Kühlkette
Neben der aktiven Kühlung gibt es die Möglichkeit, Arzneimittel passiv zu kühlen. Die passive Kühlung wird allerdings nur als Zwischenstufe zwischen der aktiven Kühlung eingesetzt, meist bei Transporten zwischen Großhändler und Apotheken. Hierbei sind die Fahrzeuge nicht mit Kühltechnik ausgestattet. Um die Temperaturintervalle einzuhalten, werden bei Transporten geeignete Isolationstechniken verwendet. Abhängig von der geographischen Lage, in der die Transporte durchgeführt werden, können Transporte mit passiver Kühlung ganzjährig, saisonal oder nur vereinzelt durchgeführt werden. Hinzu kommen Dauer der Transporte, sowie die Innenraumisolation der Transporter selbst. Aufgrund der hohen Kosten für aktiv gekühlte Transporte entscheiden Transportdienstleister und Großhändler oft tages- und wetterabhängig ob passive Transporte infrage kommen. Hierzu wird bei der Entscheidungsfindung auf Daten zurückgegriffen, die im Rahmen des Temperaturmonitoring gesammelt wurden. Die Entscheidung ob Transporte aktiv oder passiv gekühlt werden, basiert auch auf der Isolation der Arzneimittelverpackung selbst. Neben dem informativen Nutzen der Verpackung muss diese auch physikalischen, biologischen, klimatischen und chemischen Belastungen[11] standhalten.
Kritik
In Deutschland sind Logistikdienstleister, die die Arzneimittel der Versandapotheken an die Kunden ausliefern, den Good Distribution Practices (GDP) nicht unterworfen, anders als etwa Arzneimittelgroßhändler, für die diese Vorschriften verpflichtend sind. Vielmehr müssen die Versandapotheken gemäß Apothekengesetz und Apothekenbetriebsordnung sicherstellen, dass ein Arzneimittel so „verpackt, transportiert und ausgeliefert wird, dass seine Qualität und Wirksamkeit erhalten bleibt.“,[12] was in der Praxis aber so gut wie nicht umsetzbar und nicht kontrollierbar ist.[13]
Weitere Vertriebsstrukturen
Online-Handel
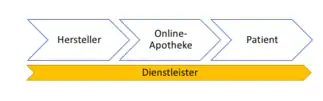
Innerhalb der aktuellen Vertriebsstrukturen gewinnt der Online-Handel zunehmend an Bedeutung. Die zunehmende Digitalisierung und der wachsenden eCommerce Handel sind für diese Entwicklung mitverantwortlich. Die Bestellung von apothekenpflichtigen oder freiverkäuflichen Arzneimitteln ist durch das Erstellen von Kundenkonto und die Angabe von Zahlungsdaten über Plattformen problemlos möglich. In Deutschland bietet ein großer Versandhändler über Partner-Apotheken eine Plattform für den Online-Handel.[14] Diverse Konzepte haben sich bislang nicht durchsetzen können.[15][16] Weitere Vorbestellsysteme und -portale sind in der Pipeline.[17] Ein niederländischer Versandhändler hat angekündigt, Plattform-Ökonomie nach dem Vorbild von Amazon etablieren zu wollen.[18]
Versandhandel innerhalb Europas
In den meisten EU-Ländern ist der Versand rezeptpflichtiger Arzneimittel verboten. Für den Versandhandel von Arzneimitteln nach Deutschland sind neben deutschen Versandapotheken mit Stand Juni 2018 Händler aus Island, Niederlande (soweit Versandapotheken gleichzeitig eine Präsenzapotheke unterhalten), Schweden (nur verschreibungspflichtige Arzneimittel), Tschechien (nur verschreibungsfreie Arzneimittel) und das Vereinigte Königreich zugelassen.[19]
Arzneimittelfälschungen
Arzneimittelfälschungen stellen eins der größten Probleme in der Pharma-Lieferkette dar. Aufgrund der zunehmenden Globalisierung und preis- und nachfragegesteuerten Import/Export-Handel werden Arzneimittel in vielen Fällen auf ihrem Weg vom Hersteller zu den Patienten mehrmals aufgekauft, umgepackt und wieder weiter verkauft. Der Verkauf von Arzneimitteln in Länder mit anderen Gesetzen oder Kontrollregelungen bietet Raum für kriminelle Handlungen. Mit End-to-End Visability über die gesamte Lieferkette sowie fälschungssicheren, standardisierten Barcodes versuchen Unternehmen den Arzneimittelhandel besser zu schützen und zu überwachen.
Die securPharm e. V. baut in Deutschland ein System zur Echtheitsprüfung von Arzneimitteln auf. Gesetzliche Grundlage für die Arbeit von securPharm sind die EU-Fälschungsschutzrichtlinie 2011/62/EU und die delegierte Verordnung (EU) Nr. 2016/161, nach der ab 9. Februar 2019 jedes verschreibungspflichtige Arzneimittel vor Abgabe an den Patienten einer Echtheitsprüfung unterzogen werden muss.[20] Mit einer EU-weiten Serialisierung durch die Richtlinie möchte die Europäische Union Einheitlichkeit schaffen und Fälschungen schnell aufdecken.
Einzelnachweise
- Pharma-Daten 2017. (PDF) (Nicht mehr online verfügbar.) Ehemals im Original; abgerufen am 30. Mai 2018. (Seite nicht mehr abrufbar, Suche in Webarchiven) Info: Der Link wurde automatisch als defekt markiert. Bitte prüfe den Link gemäß Anleitung und entferne dann diesen Hinweis.
- Pharmaindustrie in Deutschland. Abgerufen am 30. Mai 2018.
- Alles über die Pharmabranche in Deutschland. Abgerufen am 30. Mai 2018.
- Miebach Consulting GmbH (Hrsg.): Herausforderungen in Sicht! – Supply-Chain-Trends in der europäischen Pharmaindustrie. 2016.
- Avoxa – Mediengruppe Deutscher Apotheker GmbH: Pharmazeutische Zeitung online: Bringdienst: Botschafter der Apotheke. Abgerufen am 30. Mai 2018.
- Daten und Fakten Arzneimittelversandhandel für rezeptpflichtige und OTC-Arzneimittel in Deutschland, BVDA 2016.
- Pick-up-Verbot für Vor-Ort-Apotheken
- Import / Reimport /Parallelimport…, DAZ 40/2011.
- C. W. Stoller (Hrsg.): Pharmalogistik. 2017.
- Europäische Kommission: Leitlinien vom 5. November 2013 für die gute Vertriebspraxis von Humanarzneimitteln
- C. W. Stoller (Hrsg.): Pharmalogistik. 2017.
- § 11a ApoG.
- Versand ist nicht gleich Versand. DAZ-online, 14. Dezember 2015.
- Amazon startet Arzneimittelversand mit Münchener Apotheke. DAZ-online, 10. Mai 2017.
- Dedendo ist Geschichte, apotheke adhoc, 6. Dezember 2013.
- Otto beendet Lieferdienst Vitabote, apotheke adhoc, 13. Januar 2014.
- Die App-otheken kommen. apotheke adhoc, 22. März 2018.
- DocMorris strebt zur Plattform-Ökonomie à la Amazon. apotheke adhoc, 22. November 2017.
- Illegaler Arzneimittelversand und Arzneimittelfälschungen (Memento des Originals vom 12. Juni 2018 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. DIMDI; abgerufen am 7. Juni 2018.
- securPharm e. V. · Über securPharm. Abgerufen am 30. Mai 2018.