Pechmann-Pyrazol-Synthese
Die Pechmann-Pyrazol-Synthese ist eine Namensreaktion der Organischen Chemie, welche in ihrer klassischen Methode vom deutschen Chemiker Hans von Pechmann (1850–1902) entdeckt wurde. Pyrazole wurden bereits 1883 von Ludwig Knorr synthetisiert.[1]
Übersichtsreaktion
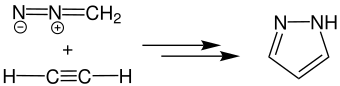
Durch die langsame Reaktion zwischen Diazomethan und Acetylen wird das Produkt Pyrazol erhalten:
Reaktionsmechanismus
Diazomethan tritt in drei unterschiedlichen mesomeren Grenzstrukturen auf:

Im Folgenden ist die Pechmann-Pyrazol-Synthese in ihrer klassischen Variante, der Reaktion zwischen Diazomethan und Acetylen 1, dargestellt. Zunächst wird das Kohlenstoffatom des Acetylens 1 vom negativ geladenen Kohlenstoffatom des Diazomethans angegriffen. Durch diese 1,3-dipolare Cycloaddition wird das nichtaromatische 3H-Pyrazol 2 gebildet.[2]
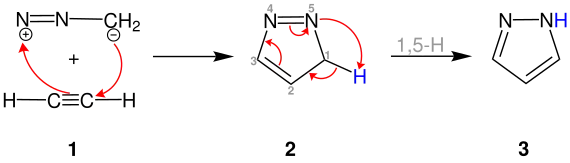
Durch anschließende 1,5-H-Verschiebung entsteht das Produkt Pyrazol 3. Die Reaktion kann ebenfalls mit Alkenen durchgeführt werden. Bei Verwendung von Ethylen wird beispielsweise Pyrazolin erhalten. Dabei findet jedoch keine weitere H-Verschiebung statt.
Im nächsten Beispiel wird die im oberen Beispiel zweite gezeichnete mesomere Grenzstruktur des Diazomethans mit dem Ester 4 zur Reaktion gebracht. Auch hier erfolgt eine dipolare 1,3-Cycloaddition, wodurch das Pyrazolinderivat 5 entsteht.
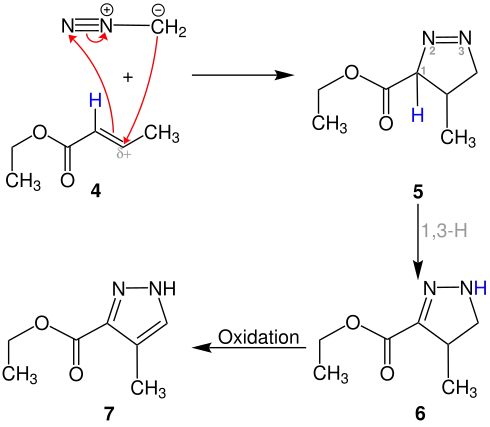
Nun erfolgt eine 1,3-H-Verschiebung unter Bildung von Struktur 6. Durch Oxidation kann das Pyrazolderivat 7 gewonnen werden.
Nachteile
Die von Pechmann angewandte Methode erforderte den Einsatz karzinogener Hydrazine. Außerdem traten häufig Probleme in Bezug auf die Regioselektivität der Reaktion auf, die eine begrenzte Substratbreite zur Folge hatte. Darum wird im Folgenden eine Alternative dargestellt.
Moderne Variante
Neumann, Suri und Glorius beschrieben 2010 eine moderne Methode zur Synthese von tetrasubstituierten Pyrazolderivaten aus Estern von Enaminen und Nitrilen. Die oben genannten Nachteile älterer Synthesewege wurden nahezu komplett behoben. Dabei wurde der folgende Mechanismus vorgeschlagen:
Zunächst koordiniert das Lewis-saure Kupfernitril 8 an das Enaminoester 9. Ein bindendes Elektronenpaar der C=C-Doppelbindung des nucleophilen Enaminoesters bildet dabei eine Bindung zum partiell positiv polarisierten Kohlenstoffatom des Nitrils aus. Durch Eliminierung eines Essigsäuremoleküls entsteht das 1,3-Bisimin 10. In dieser Variante ist es durch die gezielte Bestimmung der Reste möglich, unsymmetrische Pyrazole mit nahezu vollständiger Regioselektivität zu bilden.[3]
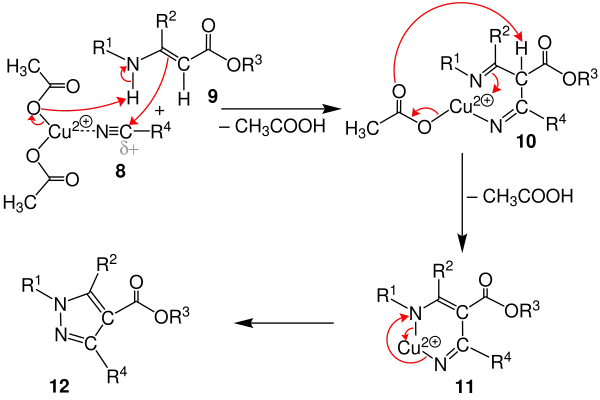
Durch erneute Eliminierung eines Essigsäuremoleküls und oxidative N-N-Bindungsknüpfung wird der Kupfer(II)-Chelatkomplex 11 gebildet. Eine anschließende reduktive Eliminierung von Kupfer liefert das tetrasubstituierte Pyrazolderivat 12.
Literatur
- Jie Jack Li: Name reactions, a collection of detailed reaction mechanism. Vol 1. Springer 2002. ISBN 3-540-43024-5.
- Z. Wang: Comprehensive Organic Name Reactions and Reagents, Vol 2. John Wiley & Sons, Hoboken, New Jersey 2009, S. 2147–2150, ISBN 978-0-471-70450-8.
- Theophil Eichner, Siegfried Hauptmann, Andreas Speicher: The chemistry of heterocycles : structure, reactions, synthesis, and applications, Vol 3. Wiley-VCH, Weinheim 2012, S. 236–243, ISBN 978-3-527-32868-0.
- Paul Walden: Geschichte der organischen Chemie seit 1880, Bd. 2. Springer-Verlag, Berlin 1972.
- Hermann Römpp, Jürgen Falbe, Eckard Amelingmeier: Römpp-Lexikon Chemie, Vol 10. Thieme-Verlag, Stuttgart 1999, S. 2183, ISBN 3-13-107830-8.
- Robert Ebermann, Ibrahim Elmadfa: Lehrbuch Lebensmittelchemie und Ernährung, Vol 1. Springer-Verlag, Vienna 2011, S. 382, ISBN 978-3-7091-0210-7.
Einzelnachweise
- Ludwig Knorr: Einwirkung von Acetessigester auf Phenylhydrazin, Berichte der deutschen chemischen Gesellschaft 1883, 2, 2597–2599, doi:10.1002/cber.188301602194.
- H. v. Pechmann: Pyrazol aus Acetylen und Diazomethan, Berichte der deutschen chemischen Gesellschaft 1898, 3, 2950–2951, doi:10.1002/cber.18980310363.
- Julia J. Neumann, Mamta Suri, Frank Glorius: Effiziente Pyrazolsynthese durch eine oxidative C-C/N-N-Bindungsknüpfungskaskade, Angewandte Chemie 2010, 42, 7957–7961, doi:10.1002/ange.201002389.