Neratinib
Neratinib (ehemals HKI-272), (Handelsname: Nerlynx; Vertrieb: Pierre Fabre) ist ein Arzneistoff aus der Gruppe der Tyrosinkinase-Inhibitoren, der zur Behandlung von Brustkrebs im Frühstadium nach einer Operation angewendet wird, um das Risiko eines erneuten Auftretens der Erkrankung (Rezidiv) zu senken. Neratinib wird nach einer Behandlung mit Trastuzumab (Herceptin; ein Arzneimittel für den gleichen Zweck) angewendet.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
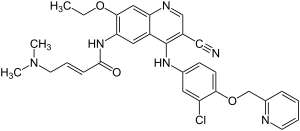 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Neratinib | |||||||||||||||||||||
| Andere Namen |
(2E)-N-[4-[[3-Chlor-4-[(pyridin-2-yl)methoxy]phenyl]amino]-3-cyan-7-ethoxychinolin-6-yl]-4-(dimethylamino)but-2-enamid | |||||||||||||||||||||
| Summenformel | C30H29Cl1N6O3 | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
L01XE45 | |||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 557,04 g·mol−1 | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Im Juli 2017 hat die US-amerikanische Zulassungsbehörde (FDA) Neratinib zugelassen.[2] Die Europäische Kommission erteilte die EU-Zulassung im August 2018.[3][4]
Klinische Angaben
Anwendungsgebiete
Neratinib / Nerlynx ist geeignet (indiziert) für die erweiterte adjuvante Behandlung von erwachsenen Patienten mit Hormonrezeptor-positivem HER2-überexprimiertem/amplifiziertem Brustkrebs in einem frühen Stadium, die vor weniger als einem Jahr eine Trastuzumab-basierte adjuvante Therapie abgeschlossen haben.[3]
Es dient nur zur Anwendung bei Brustkrebs, der hohe Spiegel eines Proteins produziert, das als HER2 bezeichnet wird und dabei hilft, dass sich Zellen teilen und wachsen (HER2-positiver Brustkrebs), und der außerdem Rezeptoren (Ziele) für die weiblichen Geschlechtshormone aufweist (Hormonrezeptor- positiver Brustkrebs).[5]
Unerwünschte Wirkungen
Das Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit.
Die am häufigsten auftretenden Nebenwirkungen mit beliebigem Schweregrad waren Durchfall (93,6 %), Übelkeit (42,5 %), Erschöpfung (27,3 %), Erbrechen (26,8 %), Bauchschmerzen (22,7 %), Ausschlag (15,4 %), Appetitlosigkeit (13,7 %), Schmerzen im Oberbauch (13,2 %), Stomatitis (11,2 %) und Muskelspasmen (10,0 %). Es kann sich dabei um schweren Durchfall handeln, der mit Austrocknung (Dehydratation) einhergeht. Durchfall tritt gewöhnlich früh während der ersten oder zweiten Woche der Behandlung mit Nerlynx auf und kann wiederholt auftreten.
Patienten sollten eine vorsorgliche Durchfallbehandlung (z. B. mit Loperamid) zusammen mit der ersten Nerlynx-Dosis zu Beginn und während der ersten 1–2 Monate der Nerlynx-Behandlung einnehmen, sodass eine Häufigkeit von 1–2 Stuhlgängen pro Tag erreicht wird. Die Behandlung von Durchfall erfordert die korrekte Anwendung eines Durchfallmedikaments, Ernährungsänderungen und eine angemessene Änderung der Nerlynx-Dosis.[3] Die hohen Nebenwirkungsraten (Durchfall) sind u. a. auch darauf zurückzuführen, dass in der Zulassungsstudie ExteNET (s. u.) eine vorsorgliche Durchfallbehandlung nicht vorgeschrieben war.[6]
Besondere Patientengruppen
Ältere Patienten (≥ 65 Jahre) haben ein erhöhtes Risiko von Niereninsuffizienz und Dehydratation, welche eine Komplikation von Durchfall sein können. Deswegen sollten diese Patienten sorgfältig überwacht werden. Patienten mit einer chronischen Erkrankung des Gastrointestinaltrakts und Durchfall als ein Hauptsymptom sollten sorgfältig überwacht werden.[3]
Pharmakologische Eigenschaften
Wirkungsmechanismus
Neratinib bindet an das Protein HER2 auf den Krebszellen und blockiert so seine Wirkung. Da HER2 dazu beiträgt, dass Zellen wachsen und sich teilen, hilft das Blockieren des Proteins, diese Zellen am Wachstum zu hindern, und beugt einem erneuten Auftreten des Krebses vor.
Aufnahme und Verteilung im Körper
Die Resorption nach der oralen Verabreichung von 240 mg war langsam und die Peak-Plasmakonzentrationen von Neratinib traten etwa 7 Stunden nach der Verabreichung auf.
Zulassungsstudie
- ExteNET (NCT00878709): Nerlynx hat sich in einer Hauptstudie, an der 2.840 Frauen mit HER2-positivem Brustkrebs im Frühstadium teilnahmen, die bereits Trastuzumab erhalten hatten, bei der Vorbeugung eines erneuten Auftretens des Brustkrebses als wirksamer als Placebo (eine Scheinbehandlung) erwiesen. Rund 94 % der Frauen, die eine einjährige Behandlung mit Nerlynx erhalten hatten, lebten ein weiteres Jahr nach Beenden der Behandlung mit Nerlynx ohne ein erneutes Auftreten des Krebses, verglichen mit 92 % derjenigen, die Placebo erhalten hatten. Wenn nur Frauen mit Hormonrezeptor-positivem Krebs berücksichtigt wurden, lebten 95 % derjenigen, denen Nerlynx verabreicht wurde, ein weiteres Jahr ohne ein erneutes Auftreten des Krebses, verglichen mit 91 % derjenigen, die Placebo erhalten hatten.[7]
Literatur
- José Baselga, Robert E. Coleman, Javier Cortés and Wolfgang Jannid: Advances in the management of HER2-positive early breast cancer In: Crit Rev Oncol Hematol Band 119, Dezember 2017, S. 113–122, doi:10.1016/j.critrevonc.2017.10.001. PMID 29042085.
- Arlene Chan, Suzette Delaloge, Frankie A Holmes, Beverly Moy, Hiroji Iwata, Vernon J Harvey et al.: Neratinib after trastuzumab-based adjuvant therapy in patients with HER2-positive breast cancer (ExteNET): a multicentre, randomised, double-blind, placebo-controlled, phase 3 trial In: The Lancet Oncology Band 17, Nummer 3, Februar 2016, S. 367–377, doi:10.1016/S1470-2045(15)00551-3.
- Ernst Mutschler et al.: Mutschler – Arzneimittelwirkungen Lehrbuch der Pharmakologie und Toxikologie. 10. Auflage. Wissenschaftl. Verlagsgesellschaft, Stuttgart 2012, ISBN 978-3-8047-2898-1.
Einzelnachweise
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- FDA approves neratinib for extended adjuvant treatment of early stage HER2-positive breast cancer, PM FDA vom 17. Juli 2017 (engl.), abgerufen am 28. Oktober 2019.
- Zusammenfassung der Merkmale des Arzneimittels, EPAR der EMA, abgerufen am 28. Oktober 2019.
- Nerlynx Neratinib, EPAR der EMA (engl.), abgerufen am 28. Oktober 2019.
- Übersicht über Nerlynx und Begründung für die Zulassung in der EU, EMA, abgerufen am 28. Oktober 2019.
- Puma Biotechnology Presents Interim Results of Phase II CONTROL Trial of Neratinib in Extended Adjuvant Treatment of HER2-Positive Early Stage Breast Cancer at the ASCO 2019 Annual Meeting (Memento vom 4. November 2019 im Internet Archive), PM Puma Biotechnology vom 2. Juni 2019, abgerufen am 4. November 2019
- Prof. Miguel Martin, MD Frankie A Holmes, MD Bent Ejlertsen, MD Suzette Delaloge, MD Beverly Moy, MD Hiroji Iwata, MD et al.: Neratinib after trastuzumab-based adjuvant therapy in HER2-positive breast cancer (ExteNET): 5-year analysis of a randomised, double-blind, placebo-controlled, phase 3 trial In: The Lancet Oncology Band 18, Nummer 12, Dezember 2017, S. 1688–1700, doi:10.1016/S1470-2045(17)30717-9. PMID 29146401.
Weblinks
- Krebsinformationsdienst (KID). Brustkrebs: Brustkrebs
- ClinicalTrials.gov: Study Evaluating The Effects Of Neratinib After Adjuvant Trastuzumab In Women With Early Stage Breast Cancer (ExteNET)
- vfa: In Deutschland zugelassene Arzneimittel für die Personalisierte Medizin
- DAZ: Hoffnungsträger für viele schwerkranke Patienten
- Hersteller Pierre Fabre: https://nerlynx.com