Nepetalacton
Nepetalacton ist eine chemische Verbindung und ein Naturstoff aus der Gruppe der Iridoiden.
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
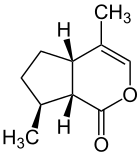 | ||||||||||
| Struktur von cis,trans-Nepetalacton | ||||||||||
| Allgemeines | ||||||||||
| Name | Nepetalacton | |||||||||
| Andere Namen |
5,6,7,7a-Tetrahydro-4,7-dimethyl-cyclopenta[c]pyran-1-(4aH)-on | |||||||||
| Summenformel | C10H14O2 | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 166,22 g·mol−1 | |||||||||
| Aggregatzustand |
flüssig | |||||||||
| Siedepunkt | ||||||||||
| Brechungsindex |
1,4859 (25 °C)[2] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||
Vorkommen und Wirkung
Nepetalacton wurde im Hinterbeinsekret von weiblichen Blattläusen der Art Myoura vicia nachgewiesen und dient hier als Pheromon.
Es kommt auch in der Katzenminze (Nepeta cataria) vor und ist verantwortlich dafür, dass Katzen vom Geruch dieser Pflanze angelockt werden. Die natürliche Funktion des Nepetalactons in der Pflanze dürfte die eines Repellents gegen Insektenfraß sein, was zumindest in Versuchen mit der Reinsubstanz gezeigt werden konnte.[4]
Bei der Maus wirkte Nepetalacton als Opioid auf bestimmte Rezeptor-Subtypen.[5]
Analytik
Die zuverlässige qualitative und quantitative Bestimmung von Nepetalacton gelingt nach angemessener Probenvorbereitung durch Einsatz der Gaschromatographie mit Massenspektrometrie-Kopplung.[6][7] Auch der Einsatz der HPLC in Kopplung mit der Massenspektrometrie kann zur zuverlässigen Bestimmung verwendet werden.[8]

Biosynthese
Als Iridoid folgt die Biosynthese nach der Iridoidsynthese. Nepetalacton wird in der Katzenminze aus Geranylpyrophosphat (GPP) synthetisiert. Durch die Geraniol-Synthase wird GPP zu einem Geraniol. Hierbei wird aus dem Diphosphat-Rest ein Hydroxy-Rest. Im weiteren Verlauf entsteht ein Diol, durch das Enzym Geraniol-8-hydroxylase. Das entstandene Diol Geraniol wird weiter oxidiert zu einem Dialdehyd mit dem Enzym Oxidoreduktase. Das entstandene Produkt wird als 8-Oxogeranial bezeichnet.[9]
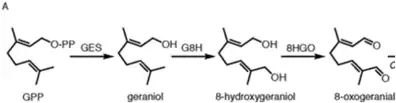
In der Irioid-Synthase, reagiert NADP am C3 Atom des 8-Oxogeranial. Die Doppelbindung zwischen C2 und C3 bewegt sich zu C1 und C2, und der doppelt gebundene Sauerstoff ist nur noch einfach gebunden. Es entsteht der Zwischenzustand 8-Oxocitronellylenol oder -enolat.[10]
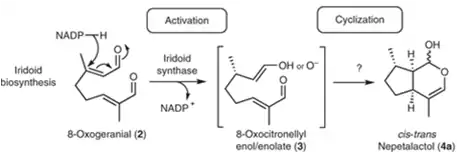
Nach diesen Schritt sind alle weiteren Reaktionen noch nicht vollständig bekannt. Es werden verschiedene Theorien entwickelt. Teil einer Theorie ist die Abhängigkeit der Reaktion vom pH-Wert. So lässt sich beobachten, dass bei geringem pH-Wert das vollständig cyclisiertes Produkt Nepetalalctol entsteht.
Die wahrscheinlichste Erklärung für diese Reaktion ist dabei, dass die Doppelbindung an C1 an C6 angreift und dessen Doppelbindung nach C7 verschiebt. Im zweiten Schritt der Cyclisierung wird der dadurch doppelt gebundene Sauerstoff an C1 wieder einfach gebunden und der jetzt einfach gebundene C8-Sauerstoff greift an C1 an, was den zweiten Kreis schließt und die Cyclisierung abschließt.
Im umgekehrten Fall eines hohen pH-Werts, kann man eine geringe Entstehung des Produkts Nepetalacton vermuten. Hierbei wird angenommen, dass durch ein saures Milieu Cyclisierungsreaktionen gehemmt werden. Jedoch steigt bei einem hohen pH-Wert die Konzentration des nicht cyclisierten Produkts (S)-8-Oxocitronellal an. Vermutlich reagieren die Protonen im Milieu mit den Doppelbindungen eines Zwischenzustands, was eine Cyclisierung hemmt.
Die Hydroxygruppe des entstandenen Nepetalactols wird jetzt durch eine weitere Oxido-Reductase oxidiert. Somit entsteht der intramolekulare Ester, der die grundlegende Lactonstruktur ausmacht, und somit auch das Nepetalacton.
Dieser Vorgang hat nichts mit der Lactonisierung zu tun, doch das Endprodukt gehört doch der Stoffklasse der Lactone an. Alternativ wird der Cyclisierungs-Schritt mit einer Diels-Alder-Reaktion erklärt.
Bei der Biosynthese können unterschiedlichste Isomere auftreten. Es ist noch nicht eindeutig, wie die Isomere entstehen.[11]

Derivate
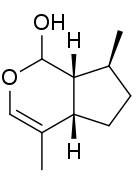
Dem in der Katzenminze vorkommenden Nepetalacton verwandt ist Nepetalactol (Summenformel C10H16O2), ein weiteres Iridoid, das im Silberwein (Actinidia polygama) vorkommt.[12]
Einzelnachweise
- Eintrag zu Iridodial. In: Römpp Online. Georg Thieme Verlag, abgerufen am 12. November 2014.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, S. 3-386.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- J. B. Harborne: Introduction to Ecological Biochemistry. 3. Auflage, Academic Press, London 1988, S. 244f., 263. ISBN 0-12-324684-9.
- Aydin S, Beis R, Oztürk Y, Baser KH, Baser C: Nepetalactone: a new opioid analgesic from Nepeta caesarea Boiss. In: J. Pharm. Pharmacol.. 50, Nr. 7, Juli 1998, S. 813–817. PMID 9720633.
- Zomorodian K, Saharkhiz MJ, Shariati S, Pakshir K, Rahimi MJ, Khashei R: Chemical Composition and Antimicrobial Activities of Essential Oils from Nepeta cataria L. against Common Causes of Food-Borne Infections., ISRN Pharm. 2012;2012:591953, PMID 22779012
- Bozari S, Agar G, Aksakal O, Erturk FA, Yanmis D: Determination of chemical composition and genotoxic effects of essential oil obtained from Nepeta nuda on Zea mays seedlings., Toxicol Ind Health 29(4), Mai 2013, S. 339–348, PMID 22312034
- Wang M, Cheng KW, Wu Q, Simon JE: Quantification of nepetalactones in catnip (Nepeta cataria L.) by HPLC coupled with ultraviolet and mass spectrometric detection., Phytochem Anal. 18(12), März/April 2007, S. 157–160, PMID 17439017
- Mehrere Autoren,Phytochemistry,: “Identification of iridoid synthases from Nepeta species: Iridoid cyclization does not determine nepetalactone stereochemistry”,. Verlag: Elsevier , Kopie von: University of York,, Oktober 2017, abgerufen am 30. Juni 2021.
- Mehrere Autoren,: “Uncoupled activation and cyclization in catmint reductive terpenoid biosynthesis”,. Nature Chemical Biology, Verlag:Nature Research,, Januar 2019, abgerufen am 30. Juni 2021 (englisch).
- Mehrere Autoren,: “Uncoupled activation and cyclization in catmint reductive terpenoid biosynthesis”,. Nature Chemical Biology, Verlag:Nature Research,, Januar 2019, abgerufen am 30. Juni 2021 (englisch).
- Reiko Uenoyama, Tamako Miyazaki, Jane L. Hurst, Robert J. Beynon, Masaatsu Adachi et al.: The characteristic response of domestic cats to plant iridoids
allows them to gain chemical defense against mosquitoes. Science Advances 7 (4), 20. Januar 2021, eabd9135; doi:10.1126/sciadv.abd9135. Dazu:
- Bioactive Compounds Found in Catnip and Silver Vine Protect Cats against Mosquito Bites, auf: sci-news vom 21. Januar 2021 (englisch)
- Masao Miyazaki, Reiko Uenoyama: Mückenschutz: Was Katzen verrückt macht, auf: orf.at vom 21. Januar 2021 (deutsch)
- Martin Vieweg: Nützliche Droge: Warum Katzen bestimmte Pflanzen lieben, auf: wissenschaft.de vom 20. Januar 2021. Quelle: Iwate-Universität