Natriumtrimetaphosphat
Natriumtrimetaphosphat ist eine anorganische chemische Verbindung des Natriums aus der Gruppe der Phosphate. Die Verbindung wurde 1834 durch Thomas Graham entdeckt.[2]
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
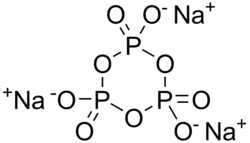 | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Natriumtrimetaphosphat | ||||||||||||
| Andere Namen | |||||||||||||
| Summenformel | Na3P3O9 | ||||||||||||
| Kurzbeschreibung |
weißer Feststoff[2] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 305,89 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest[3] | ||||||||||||
| Dichte |
2,49 g·cm−3[4] | ||||||||||||
| Löslichkeit | |||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Toxikologische Daten | |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Gewinnung und Darstellung
Natriumtrimetaphosphat kann durch Tempern von Natriumhexametaphosphat bei etwa 500 °C, durch Erhitzen von Dinatriumhydrogenphosphat und Ammoniumnitrat auf 320 °C oder durch Erhitzen von Dinatriumhydrogenphosphat auf 530 °C gewonnen werden.[5] Die Darstellung lässt sich auch durch Erhitzung einer wässrigen Natriumphosphatlösung erzielen.[6][7][8] Außerdem ist die Gewinnung durch die Reaktion von Natriumdiphosphat mit Ammoniumchlorid oder Dinatriumhydrogenphosphat mit Ammoniumnitrat möglich.[7]
Eigenschaften
Natriumtrimetaphosphat ist ein weißer Feststoff[2], der löslich in Wasser ist.[4] Er liegt bei Raumtemperatur meist als Hexahydrat vor, wobei noch andere Hydrate bekannt sind.[2] Das Hexahydrat hat eine trikline Kristallstruktur mit der Raumgruppe P1 (Raumgruppen-Nr. 2).[9] Das Anhydrat und das Monohydrat besitzen eine orthorhombische Kristallstruktur mit der Raumgruppe Pmcn (Raumgruppen-Nr. 62, Stellung 5).[10] Oberhalb von 100 °C wandelt er sich rasch in Natriumtripolyphosphat um.[11]
Verwendung
Natriumtrimetaphosphat wird als Vernetzungsmittel für amylaseresistente Stärke und zur Stärkeveresterung eingesetzt.[6] Die Verbindung fungiert auch als Zwischenprodukt in der Lebensmittelindustrie. Darüber hinaus dient sie als Korrosionshemmer, Anti-Kalker, Füllstoff, Ausrüstungsmittel, Galvanisierungsmittel und Oberflächenbehandlungsmittel.[4] Es wird auch in Zahnpasta eingesetzt.[5]
Einzelnachweise
- Eintrag zu SODIUM TRIMETAPHOSPHATE in der CosIng-Datenbank der EU-Kommission, abgerufen am 23. Oktober 2021.
- H. J. Emeléus, A. G. Sharpe: Advances in Inorganic Chemistry and Radiochemistry. Academic Press, 1962, ISBN 978-0-08-057853-8, S. 18 (eingeschränkte Vorschau in der Google-Buchsuche).
- Datenblatt Trisodium trimetaphosphate, ≥95% bei Sigma-Aldrich, abgerufen am 11. Februar 2019 (PDF).
- Datenblatt Sodium trimetaphosphate bei AlfaAesar, abgerufen am 11. Februar 2019 (PDF) (JavaScript erforderlich).
- Eintrag zu Sodium Trimetaphosphate in der Hazardous Substances Data Bank, abgerufen am 11. Februar 2019 (online auf PubChem).
- Patent DE19724613B4: Verfahren zur Herstellung von Natriumtrimetaphosphat. Angemeldet am 11. Juni 1997, veröffentlicht am 6. August 2009, Anmelder: Chemische Fabrik Budenheim KG, Erfinder: Joachim Markmann et al.
- William A. Hart, O. F. Beumel, Thomas P. Whaley: The Chemistry of Lithium, Sodium, Potassium, Rubidium, Cesium and Francium Pergamon Texts in Inorganic Chemistry. Elsevier, 2013, ISBN 978-1-4831-8757-0, S. 496 (eingeschränkte Vorschau in der Google-Buchsuche).
- Doan Pham Minh, Jocelyn Ramaroson, Ange Nzihou, Patrick Sharrock: One-Step Synthesis of Sodium Trimetaphosphate (Na3P3O9) from Sodium Chloride and Orthophosphoric Acid . In: Industrial & Engineering Chemistry Research. 51, 2012, S. 3851, doi:10.1021/ie201085b.
- I. Tordjman, A. Durif, J. C. Guitel: Structure cristalline du trimétaphosphate de sodium hexahydraté: Na3P3O9·6H2O. In: Acta Crystallographica Section B Structural Crystallography and Crystal Chemistry. 32, 1976, S. 1871, doi:10.1107/S0567740876006560.
- H. M. Ondik: The structure of anhydrous sodium trimetaphosphate Na3P3O9, and the monohydrate, Na3P3O9·H2O. In: Acta Crystallographica. 18, 1965, S. 226, doi:10.1107/S0365110X65000518.
- Arthur D. F. Toy: The Chemistry of Phosphorus Pergamon Texts in Inorganic Chemistry. Elsevier, 2016, ISBN 978-1-4831-3959-3, S. 526 (eingeschränkte Vorschau in der Google-Buchsuche).