Morbus McArdle
Der Morbus McArdle (McArdle-Myopathie, McArdle-Krankheit, McArdle-Syndrom), auch als Glykogenspeicherkrankheit Typ V (GSD5) bezeichnet, ist eine Glykogenspeicherkrankheit, die 1951 von dem Kinderarzt Brian McArdle (1911–2002) erstmals beschrieben worden ist.[1] Zu Grunde liegt ein Defekt der in der Skelettmuskulatur vorkommenden Isoform des Enzyms Glykogenphosphorylase, die auch als Myophosphorylase bezeichnet wird. Die Krankheit wird autosomal-rezessiv vererbt.
| Klassifikation nach ICD-10 | |
|---|---|
| E74.0 | Glykogenspeicherkrankheit (Glykogenose) McArdle-Krankheit |
| ICD-10 online (WHO-Version 2019) | |
Pathogenese
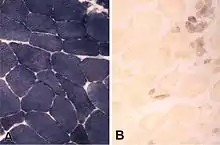
Bei Patienten mit dieser Erkrankung liegt eine Energieverwertungsstörung vor. Der Speicherung und Bereitstellung des Energieträgers Glucose in der Muskulatur dient das Polysaccharid Glykogen. Die Funktion der Myophosphorylase besteht darin, aus dem Glykogen Glukosereste zu mobilisieren und somit im Rahmen der Glykolyse oder des oxidativen Citratzyklus zur Energiegewinnung verfügbar zu machen. Ist diese Entspeicherung der Glukose durch einen Enzymdefekt gestört, kommt es zu einer Anhäufung von Glykogen sowie, insbesondere bei starker Beanspruchung, zu einer Energieunterversorgung der Muskulatur.
Symptomatik
Symptome treten bereits im jungen Erwachsenenalter auf. Charakteristisch sind eine verminderte Belastbarkeit der Muskulatur (Myasthenie), Muskelschmerzen (Myalgien), Muskelversteifungen und Krämpfe. Die Beschwerden entstehen entweder nach kurzfristiger schwerer Beanspruchung der Muskulatur (Krafttraining, Tragen schwerer Lasten), oder nach weniger schweren, aber lang andauernden Belastungen (Laufen, Wandern). Moderate Muskelbelastungen können hingegen über eine relativ lange Zeit ohne nennenswerte Beschwerden aufrechterhalten werden. Viele Betroffene berichten, dass ein Pausieren nach den ersten Auftreten von Symptomen zu einer anschließend guten und beschwerdearmen Muskelbelastbarkeit führt. Dieser Effekt ist charakteristisch und wird im Englischen als Second-Wind-Phenomenon bezeichnet.
Manche Patienten berichten ferner über eine Dunkelfärbung des Urins nach körperlicher Belastung. Hierbei handelt es sich um eine Ansammlung von Muskelabbauprodukten im Harn (Myoglobinurie) als Resultat der verstärkten Muskelschädigung (Rhabdomyolyse), da durch den Energiemangel die Gewebsintegrität der Muskulatur nicht aufrechterhalten werden kann. In schweren Fällen kann die Myoglobinurie zu einem akuten Nierenversagen führen.
Diagnose
Als unspezifisches Zeichen der Muskelschädigung ist die Blutkonzentration der Kreatinkinase (CK) insbesondere nach körperlicher Beanspruchung erhöht. Weiterhin bestehen Erhöhungen des Ammoniak- und Harnsäurespiegels. Belastungen unter anaeroben Bedingungen führen nicht zu einem Anstieg des Laktats im Blut, sondern zu einem starken Anstieg des Ammoniaks. Dies kann auf eine Störung des Glykogenabbaus in der Muskelzelle hinweisen, ist aber kein pathognomonisches Zeichen für die McArdle-Erkrankung, denn ähnliche Befundkonstellationen finden sich auch bei anderen enzymatischen Störungen des Glykogenabbaus.
In der Muskelbiopsie ist histologisch in der PAS-Färbung eine vermehrte Glykogeneinlagerung in die Muskelfasern nachweisbar. Häufig besteht eine selektive Atrophie der Typ-I-Muskelfasern. Als typisch gelten subsarkolemmale Vakuolen sowie eigentümliche Störungen des intermyofibrillären Netzwerks in der NADH-Färbung, die sogenannten Linearisierungen. Enzymhistochemisch ist die Aktivität der Phosphorylase deutlich reduziert oder aufgehoben.[2] Die Diagnose kann gegebenenfalls durch molekulargenetische Untersuchungen zum Nachweis einer PGYM-Mutation weiter erhärtet werden.[3]
Der Morbus McArdle kann auch ohne den operativen Eingriff einer Muskelbiopsie mit Hilfe der nicht invasiven 31Phosphor-Magnetresonanzspektroskopie (31P-MRS) in Kombination mit einem moderaten Muskelbelastungstest diagnostiziert werden. Die 31P-MRS bestimmt während der Belastung im Muskel die energiereichen Phosphate und den intrazellulären pH-Wert. Ein gesunder Muskel mit einem intakten glykolytischen Stoffwechsel bildet parallel zum Abbau von Phosphokreatin (PKr) soviel Laktat, dass nach einem kurzen anfänglichen pH-Anstieg ein Abfallen des intrazellulären pH-Wertes anhand der Spektren zu erkennen ist. Die glykolytische ATP-Bildung verzögert bei Gesunden im Verlauf einer konstanten Belastung die Abbaurate an PKr. Die Konzentration an ATP bleibt unter Belastung bei Gesunden konstant. Die Erholungs-Geschwindigkeit des PKr nach einer Belastung reflektiert den sauerstoffabhängigen Stoffwechsel im Muskel, der bei Gesunden vom Trainingszustand abhängt. Bei Patienten mit Muskelglykogenosen fehlt die Laktat-Bildung. Der pH-Wert steigt daher im Verlauf der Muskelkontraktion als Folge des PKr-Abbaus kontinuierlich bis auf Werte von 7,3 an. Die Rate des PKr-Abbaus verzögert sich nicht, sondern steigt im Verlauf einer konstanten Belastung sehr häufig sogar an. In den meisten Fällen nimmt dann auch die Konzentration an ATP im Muskel ab. Die Erholung des PKr nach einer Belastung ist bei Patienten mit McArdle-Erkrankung häufig pathologisch verzögert. Eine Defizienz von Enzymen der Glykolyse unterscheidet sich von einer Defizienz des primären Glykogenabbaus in der Akkumulation von Zuckerphosphaten während Belastung.[4][5]
Therapie
Eine ursächliche Therapie steht bisher nicht zur Verfügung. Bei dauerhafter Schwäche der Muskulatur kann Physiotherapie sinnvoll sein. Ganz im Vordergrund steht jedoch der Versuch der diätetischen Beeinflussung durch die gezielte Zufuhr von Glukose oder Fruktose kurz vor oder während körperlicher Belastungen.[6] Durch Ausdauertraining unterhalb der anaeroben Schwelle kann eine deutliche Verbesserung der Leistungsfähigkeit erreicht werden.[7] Eine niedrigdosierte Behandlung mit Kreatin ging in einer kleinen klinischen Studie mit einer signifikanten Verbesserung der Muskelbeschwerden im Vergleich zu Placebo einher.[8] Die Lebenserwartung ist nicht wesentlich beeinträchtigt.
Einzelnachweise
- McArdle: Myopathy due to a defect in muscle glycogen breakdown. In: Clinical Science. 1951, 10: S. 13–33.
- Pongratz u. a.: Zur Morphologie und Biochemie der Glykogenose Typ V (McArdle). In: J Mol Med 1981; 59(18), S. 1432–1440.
- Vorgerd u. a.: Mutation analysis in myophosphorylase deficiency (McArdle's disease). In: Ann Neurol. 1998; 43 (3), S. 326–331. PMID 9506549
- Zange u. a.: Breakdown of adenine nucleotide pool in fatiguing skeletal muscle in McArdle's disease: A noninvasive 31P-MRS and EMG study. In: Muscle Nerve. 2003; 27, S. 728–736.
- Vorgerd u. a.: Muskelglykogenosen. In: Deutsches Ärzteblatt. 2002; 36, S. 2328–2340.
- Quinlivan & Beynon: Pharmacological and nutritional treatment trials in McArdle disease. In: Acta Myol. 2007; 26 (1), S. 58–60. PMID 17915572
- Maté-Muñoz u. a.: Favorable responses to acute and chronic exercise in McArdle patients. In: Clin J Sport Med. 2007; 17 (4), S. 297–303. PMID 17620784
- Vorgerd u. a.: Creatine therapy in myophosphorylase deficiency (McArdle disease): a placebo-controlled crossover trial. In: Arch Neurol. 2000; 57 (7), S. 956–963. PMID 10891977 (Volltext)