Molybdän(VI)-oxidtetrachlorid
Molybdän(VI)-oxidtetrachlorid ist eine anorganische chemische Verbindung des Molybdäns aus der Gruppe der Oxidchloride.
| Kristallstruktur | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
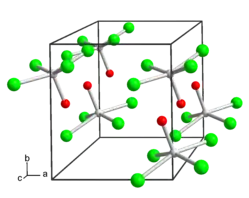 | |||||||||||||||||||
| _ Mo6+ _ Cl− _ O2− | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Molybdän(VI)-oxidtetrachlorid | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Verhältnisformel | MoOCl4 | ||||||||||||||||||
| Kurzbeschreibung |
grüner Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 253,75 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Schmelzpunkt |
100 °C[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Gewinnung und Darstellung
Molybdän(VI)-oxidtetrachlorid kann durch Reaktion von Molybdän(VI)-oxid mit Thionylchlorid gewonnen werden.[3]
Eine alternative Darstellung verläuft über die Umsetzung von geschmolzenem Molybdän(V)-chlorid mit Sauerstoff bei 215 bis 220 °C[2]:
Eigenschaften
Molybdän(VI)-oxidtetrachlorid ist ein dunkelgrüner, diamagnetischer, äußerst feuchtigkeits- und lichtempfindlicher[2] Feststoff. Er reagiert mit Chlorbenzol zu Molybdän(V)-oxidtrichlorid. Unter Stickstoff verdampft er bei 102 °C zu einem braunen Dampf. Er hat eine tetragonale Kristallstruktur vom WOCl4-Typ.[3]
Verwendung
Molybdän(VI)-oxidtetrachlorid wird als Basis für Katalysatoren für die Polymerisation von substituierten Acetylenen verwendet.[1]
Einzelnachweise
- Datenblatt Molybdenum(VI) tetrachloride oxide, 97% bei Sigma-Aldrich, abgerufen am 6. Juli 2013 (PDF).
- Alan K. Mallock: Molybdenum(VI) oxide chloride. In: Earl L. Muetterties (Hrsg.): Inorganic Syntheses. Band 10. McGraw-Hill Book Company, Inc., 1967, S. 52–57 (englisch).
- Georg Brauer (Hrsg.) u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band III, Ferdinand Enke, Stuttgart 1981, ISBN 3-432-87823-0, S. 1539.
