Molybdän(IV)-oxid
Molybdän(IV)-oxid ist eine chemische Verbindung aus der Gruppe der Oxide.
| Kristallstruktur | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
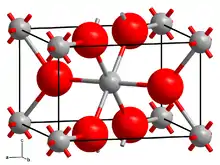 | |||||||||||||||||||
| _ Mo4+ _ O2− | |||||||||||||||||||
| Kristallsystem |
monoklin | ||||||||||||||||||
| Raumgruppe |
P21/c | ||||||||||||||||||
| Gitterparameter |
a = 558,4 pm, b = 484,2 pm, c = 560,8 pm, β = 120,59° | ||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Molybdän(IV)-oxid | ||||||||||||||||||
| Andere Namen |
Molybdändioxid | ||||||||||||||||||
| Verhältnisformel | MoO2 | ||||||||||||||||||
| Kurzbeschreibung |
rot-brauner, geruchloser Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 127,94 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
6,47 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
schlecht in Wasser (1,4 g·l−1 bei 20 °C)[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Vorkommen
Molybdän(IV)-oxid kommt sehr selten natürlich als Mineral Tugarinovit vor.[3]
Gewinnung und Darstellung
Molybdän(IV)-oxid kann durch Reduktion von Molybdän(VI)-oxid mit Wasserstoff, Ammoniak oder elementarem Molybdän oberhalb einer Temperatur von 470 °C gewonnen werden:[4][5]
Größere Einkristalle können durch chemischen Transport von polykristallinem Molybdän(IV)-oxid mit Iod im Temperaturgefälle 900 zu 700 °C gewonnen werden.[6]
Eigenschaften
Molybdän(IV)-oxid ist ein braunvioletter Feststoff, der wenig löslich in Wasser ist. Er hat eine monokline Kristallstruktur mit der Raumgruppe P21/c (Raumgruppen-Nr. 14) (a = 558,4 pm, b = 484,2 pm, c = 560,8 pm, β = 120,59°).[6] Sehr feinverteiltes Pulver ist selbstentzündlich an der Luft.[1]
Verwendung
Molybdän(IV)-oxid kann als Katalysator für Dehydrierung von Alkoholen verwendet werden.[7]
Einzelnachweise
- Eintrag zu CAS-Nr. 18868-43-4 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 11. Dezember 2012. (JavaScript erforderlich)
- WebElements: molybdenum dioxide
- Mineralienatlas: Tugarinovit
- Cotton, F. Albert; Wilkinson, Geoffrey; Murillo, Carlos A.; Bochmann, Manfred (1999), Advanced Inorganic Chemistry (6th ed.), New York: Wiley-Interscience, ISBN 0-471-19957-5
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 91.–100., verbesserte und stark erweiterte Auflage. Walter de Gruyter, Berlin 1985, ISBN 3-11-007511-3, S. 1100.
- Georg Brauer (Hrsg.) u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band III, Ferdinand Enke, Stuttgart 1981, ISBN 3-432-87823-0, S. 1542.
- A. A. Balandin and I. D. Rozhdestvenskaya, Russian Chemical Bulletin, 8, 11, (1959), 1573 doi:10.1007/BF00914749
