Magnesiumdiglutamat
Magnesiumdiglutamat ist eine chemische Verbindung des Magnesiums aus der Gruppe der Glutamate.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
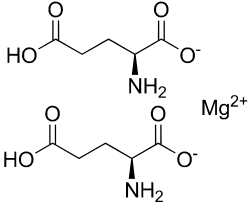 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Magnesiumdiglutamat | |||||||||||||||
| Andere Namen |
Magnesium-L-glutamat | |||||||||||||||
| Summenformel | C10H16MgN2O8 | |||||||||||||||
| Kurzbeschreibung |
weißer Feststoff[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 388,61 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
| |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Gewinnung und Darstellung
Magnesiumdiglutamat-Tetrahydrat kann durch Reaktion von Glutaminsäure mit einer wässrigen Lösung von Magnesiumcarbonat oder Magnesiumoxid gewonnen werden.[5]
Eigenschaften
Magnesiumdiglutamat und sein Tetrahydrat sind geruchlose weiße Feststoffe, die leicht löslich in Wasser sind.[4][2]
Verwendung
Magnesiumdiglutamat wird als Geschmacksverstärker verwendet.[4] Das Tetrahydrat ist ein Magnesium-Transfermittel. Es kann auch bei der Herstellung von Pufferlösungen verwendet werden.[2]
Einzelnachweise
- Eintrag zu E 625: Magnesium diglutamate in der Europäischen Datenbank für Lebensmittelzusatzstoffe, abgerufen am 21. November 2021.
- Datenblatt L-Glutaminsäure Hemimagnesiumsalz Tetrahydrat, ≥98.0% (NT) bei Sigma-Aldrich, abgerufen am 17. August 2021 (PDF).
- Alfa Chemistry: CAS 18543-68-5 Magnesium L-glutamate tetrahydrate - Alfa Chemistry, abgerufen am 17. August 2021
- Alicja Mortensen, Fernando Aguilar, Riccardo Crebelli, Alessandro Di Domenico, Birgit Dusemund, Maria Jose Frutos, Pierre Galtier, David Gott, Ursula Gundert-Remy, Jean-Charles Leblanc, Oliver Lindtner, Peter Moldeus, Pasquale Mosesso, Dominique Parent-Massin, Agneta Oskarsson, Ivan Stankovic, Ine Waalkens-Berendsen, Rudolf Antonius Woutersen, Matthew Wright, Maged Younes, Polly Boon, Dimitrios Chrysafidis, Rainer Gürtler, Paul Tobback, Andrea Altieri, Ana Maria Rincon, Claude Lambré: Re-evaluation of glutamic acid (E 620), sodium glutamate (E 621), potassium glutamate (E 622), calcium glutamate (E 623), ammonium glutamate (E 624) and magnesium glutamate (E 625) as food additives. In: EFSA Journal. Band 15, Nr. 7, 2017, ISSN 1831-4732, S. e04910, doi:10.2903/j.efsa.2017.4910, PMID 32625571 (wiley.com).
- Yoshiki Sakata, Toshiyuki Horikawa, Kuniharu Takenouchi: Alkaline Earth Salts of Glutamic Acid and Optical Resolution of their Racemic Modifications. In: Agricultural and Biological Chemistry. Band 27, Nr. 7, 1963, ISSN 0002-1369, S. 518–525, doi:10.1080/00021369.1963.10858140.
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. The authors of the article are listed here. Additional terms may apply for the media files, click on images to show image meta data.