Lithium-Nickel-Mangan-Cobalt-Oxide
Lithium-Nickel-Mangan-Cobalt-Oxide, abgekürzt als Li-NMC, LNMC, NMC oder NCM bezeichnet, sind Mischoxide des Lithiums, Nickels, Mangans und des Cobalts. Sie haben die allgemeine Formel LiaNixMnyCozO2. Die wichtigsten Vertreter haben eine Zusammensetzung mit x + y + z = 1. Diese sind mit Lithium-Cobalt(III)-oxid (LiCoO2) eng verwandt und haben wie dieses eine Schichtstruktur. Sie zählen heute zu den wichtigsten Speichermaterialien für Lithiumionen in Lithiumionenbatterien, siehe NMC-Akkumulator. Sie werden dort auf der Pluspolseite eingesetzt, die beim Entladen die Kathode bildet. Ein Akkumulator, der NMC nutzt, wird dementsprechend NMC-Akkumulator genannt; siehe dort auch die Abschnitte zu den Eigenschaften der NMC-Zellen und Akkumulatoren und zur Verwendung von NMC-Akkumulatoren.
| Kristallstruktur | ||||||||
|---|---|---|---|---|---|---|---|---|
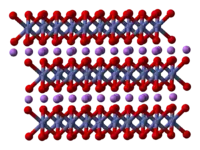 | ||||||||
| _ Li+ _ Ni3+, Mn3+ oder Co3+ (ungeordnet) _ O2− | ||||||||
| Allgemeines | ||||||||
| Name | Lithium-Nickel-Mangan-Cobalt-Oxide | |||||||
| Andere Namen |
| |||||||
| Verhältnisformel | LiaNixMnyCozO2, meist LiNi1−y−zMnyCozO2, z. B. LiNi0,33Mn0,33Co0,33O2 oder LiNi0,6Mn0,2Co0,2O2 (=NMC622) | |||||||
| Kurzbeschreibung |
keramisches, schwarzes Pulver (Handelsform)[1] | |||||||
| Externe Identifikatoren/Datenbanken | ||||||||
| ||||||||
| Eigenschaften | ||||||||
| Molare Masse | 96,40 g·mol−1 (NMC333) 96,55 g·mol−1 (NMC532) | |||||||
| Aggregatzustand |
fest | |||||||
| Schmelzpunkt | ||||||||
| Sicherheitshinweise | ||||||||
| ||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||
Kurzbezeichnungen der Varianten
Für wichtige NMC-Varianten sind Kurzbezeichnungen üblich, die das Verhältnis von Nickel, Mangan und Cobalt angeben. So wird beispielsweise LiNi0,333Mn0,333Co0,333O2 kurz als NMC111 oder auch als NMC333 bezeichnet, LiNi0,5Mn0,3Co0,2O2 als NMC532 (oder NCM523), LiNi0,6Mn0,2Co0,2O2 als NMC622 und LiNi0,8Mn0,1Co0,1O2 als NMC811.
2020 bezeichnete eine Forschergruppe NMC111 als überholt, NMC622 als Stand der Technik und NMC811 als das kommende Material.[3]
Die Oxide LiaNixMnyCozO2 mit a > 1 nennt man lithiumreich.
Eigenschaften
Die wichtigste, weil nützliche, Eigenschaft der Oxide vom NMC-Typ ist es, dass diese gemischten Lithiumoxide Lithiumionen und ein Elektron abgeben und wieder aufnehmen können. Beim Laden eines NMC-Akkus wird durch eine äußere Spannung die Abgabe von Elektronen und damit auch von Li+ erzwungen. Es läuft also die Reaktion
ab, dabei wird das NMC oxidiert. Beim Entladen läuft die Reaktion in der umgekehrte Richtung ab und gibt dabei gleichzeitig elektrische Energie ab. Die Variable in der Reaktionsgleichung hat beim Zusammenbau der Zellen oft den Wert eins. Die Variable hat einen Wert deutlich unterhalb von und damit unterhalb von eins, d. h., man kann bei gewöhnlich verwendeten Spannungen nicht alles Lithium aus dem Oxid extrahieren. Die Ladespannung von NMC-Akkus wird nämlich meist auf 4,2 V begrenzt, um die Zersetzung des Elektrolyten zu verhindern. NMC selbst kann eventuell auch bei höheren Spannungen arbeiten, z. B. wird für eine Variante eine maximale Ladespannung von 4,8 V angegeben, wobei eine Kapazität von 210 mAh/g erreicht werden kann.[2]
Vor- und Nachteile von NMC
NMC ist preiswerter als das bisher oft genutzte Lithium-Cobalt(III)-oxid LiCoO2, da Cobalt und Cobaltoxide relativ teuer sind. Im Vergleich zum relativ umweltfreundlichen Lithiumeisenphosphat ist NCM wie viele Nickel- und Cobaltverbindungen vergleichsweise gefährlich und kann vermutlich Krebs erzeugen, wenn es in den Körper gelangt.
Hersteller, Produktionsorte und -mengen
Zu den bedeutenden Herstellern von NMC zählen die BASF sowie Umicore. Umicore fertigt NMC im chinesischen Jiangmen[4] sowie in Südkorea[5] und hat mit Samsung vereinbart, ab 2020 jährlich 80.000 t NMC zu liefern[5]. Umicore will das Kathodenmaterial für den europäischen Markt in der polnischen Stadt Nysa herstellen[6], die Verarbeitung zu Lithiumionenzellen durch LG Chem erfolgt ebenfalls in Polen.[7] Die BASF produziert NCM in ihrem Werk in Elyria, Ohio.[8]
Historisches
Zu den Pionieren bei der Entdeckung und Erforschung von NMC zählt der an der Städtischen Universität Osaka OCU arbeitende Tsutomu Ohzuku, der 2001 erstmals in einer wissenschaftlichen Publikation über die heute NMC111 genannte Verbindung berichtete.[9] Zu den Entdeckern der lithiumreichen NMC-Varianten zählt Michael M. Thackeray, der am Argonne National Laboratory (ANL) arbeitet.[10] Das ANL hält Patente, die es unter anderem an die BASF lizenziert hat.[8][10]
Einzelnachweise
- Datenblatt Lithium nickel manganese cobalt oxide; powder, <0.5 μm particle size, >98 % bei Sigma-Aldrich, abgerufen am 23. Februar 2020 (PDF).
- Datenblatt Lithium nickel manganese cobalt oxide; electrode sheet bei Sigma-Aldrich, abgerufen am 29. Februar 2020 (PDF).
- Xin Sun, Xiaoli Luo, Zhan Zhang, Fanran Meng, Jianxin Yang: Life cycle assessment of lithium nickel cobalt manganese oxide (NCM) batteries for electric passenger vehicles. In: Journal of Cleaner Production. Band 273. Elsevier, November 2020, ISSN 0959-6526, S. 123006, doi:10.1016/j.jclepro.2020.123006.
- Umicore opens cathode plant. In: materialstoday.com. 3. Januar 2018, abgerufen am 8. März 2020 (englisch).
- Marjolein Scheers: Umicore announces strategic supply agreement with Samsung SDI for NMC cathode materials. In: umicore.com. 24. Oktober 2019, abgerufen am 8. März 2020 (englisch).
- Chris Randall: Umicore sets up cathode factory in Poland. In: electrive.com. Rabbit Publishing GmbH, 2. Juni 2018, abgerufen am 8. März 2020 (amerikanisches Englisch).
- Mark Kane: Umicore To Supply NMC Cathode Materials For LG Chem Batteries. In: insideevs.com. 28. September 2019, abgerufen am 8. März 2020 (englisch).
- Michael Fetcenko: BASF-ANL Collaboration on NCM Cathode Materials. (PDF) In: www.energy.gov. U.S. Department of Energy, 4. November 2014, abgerufen am 14. März 2020 (englisch).
- Tsutomu Ohzuku, Yoshinari Makimura: Layered Lithium Insertion Material of LiCo1/3Ni1/3Mn1/3 O2 for Lithium-Ion Batteries. In: Chemistry Letters. Band 30, Nr. 7, Juli 2001, ISSN 0366-7022, S. 642–643, doi:10.1246/cl.2001.642 (Mit Stand März 2020 wurde diese Arbeit laut Scopus über 1000-mal zitiert.).
- Joseph E. Harmon: Argonne’s debt to 2019 Nobel Prize for lithium-ion battery | Argonne National Laboratory. In: Argonne National Laboratory Feature Story. Argonne National Laboratory, U.S. Department of Energy Office of Science, 9. Dezember 2019, abgerufen am 14. März 2020 (englisch).

