Lithium-Cobalt(III)-oxid
Lithium-Cobalt(III)-oxid (LiCoO2), kurz LCO, ist eine chemische Verbindung von Lithium, Cobalt und Sauerstoff und wird als Material für die positive Elektrode in Lithium-Cobaltdioxid-Akkumulatoren verwendet. Die Brauchbarkeit als Elektrodenmaterial wurde 1980 von einer Forschergruppe um John B. Goodenough an der University of Oxford entdeckt.[4]
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
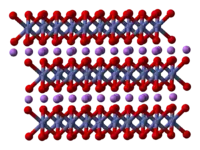 | ||||||||||||||||
| _ Li+ _ Co3+ _ O2− | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Lithium-Cobalt(III)-oxid | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Verhältnisformel | LiCoO2 | |||||||||||||||
| Kurzbeschreibung |
blaues Pulver[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 97,88 g mol−1 [2] | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
LiCoO2 ist ein Festkörper, in dessen Kristallstruktur die Lithiumatome zwischen Cobaltoxidschichten liegen.[5] Cobalt ist dabei oktaedrisch von Sauerstoffatomen koordiniert bzw. an diese gebunden, wobei eine honigwabenartige Verknüpfung entsteht. Die Symmetrie der Verbindung, ausgedrückt in der Hermann-Mauguin-Symbolik, ist die rhomboedrische Raumgruppe R3m (Raumgruppen-Nr. 166).[6]
Durch den schichtartigen Aufbau sind die Lithiumionen recht mobil und können relativ schnell innerhalb ihrer Schicht diffundieren. Das wird in Akkumulatoren ausgenutzt: bei der Entladung wird Lithium ausgebaut und in den Elektrolyt abgegeben, es entsteht LixCoO2 mit 0 < x < 1.[7] Die Struktur des Cobaltoxids bleibt dabei stabil, so dass beim Anlegen einer Spannung wieder Lithium eingebaut wird und der Akkumulator wieder aufgeladen werden kann.
Lithium-Cobalt-Dioxid ist in Wasser nicht löslich. Bei der Herstellung kann es zu Kontakt mit Stoffen kommen, die unter anderem zu Erkrankungen des Herzmuskels führen.[8]
Auf Lithium-Cobalt-Dioxid basierende Akkumulatoren neigen bei Überlastung zu thermischem Durchgehen. Bei Temperaturen ab 180 °C kommt es bei Lithium-Cobalt-Dioxid zu einer Freisetzung von Sauerstoff. Dieser freigesetzte Sauerstoff reagiert mit dem im Akkumulator eingesetzten organischen Elektrolytmaterialen exotherm und führt zu dem sich selbst steigernden und von außen nicht mehr aufhaltbaren Brand, welcher in Folge den Lithium-Cobaltdioxid-Akkumulator vollkommen zerstört.[9]
Einzelnachweise
- Datenblatt Lithium cobalt(III) oxide, 99.8% trace metals basis bei Sigma-Aldrich, abgerufen am 16. Februar 2012 (PDF).
- Datenblatt Lithium-Cobalt(III)-oxid bei AlfaAesar, abgerufen am 15. Februar 2012 (PDF) (JavaScript erforderlich)..
- Eintrag zu Lithiumcobaltdioxid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2020. (JavaScript erforderlich)
- K. Mizushima, P. C. Jones, P. J. Wiseman, J. B. Goodenough: LixCoO2 (0<x<l): A new cathode material for batteries of high energy density. In: Materials Research Bulletin. 15, 1980, S. 783–789.
- Yang Shao-Horn, Laurence Croguennec, Claude Delmas, E. Chris Nelson, Michael A. O'Keefe: Atomic resolution of lithium ions in LiCoO2. In: Nature Materials. 2, Nr. 7, Juli 2003, S. 464–467. doi:10.1038/nmat922. PMID 12806387.
- H. J. Orman and P. J. Wiseman: Cobalt(III) lithium oxide, CoLiO2: structure refinement by powder neutron diffraction. In: Acta Crystallographica Section C. 40, Nr. 1, Januar 1984, S. 12–14. doi:10.1107/S0108270184002833.
- Ondřej Jankovský, Jan Kovařík, Jindřich Leitner, Květoslav Růžička, David Sedmidubský (2016) "Thermodynamic properties of stoichiometric lithium cobaltite LiCoO2". Thermochimica Acta, volume 634, pages 26-30. doi:10.1016/j.tca.2016.04.018
- Donald G. Barceloux, Donald Barceloux: Cobalt. In: Journal of Toxicology Clinical Toxicology. 37, Nr. 2, 1999, S. 201–216. doi:10.1081/CLT-100102420.
- Vehicle Battery Safety Roadmap Guidance. National Renewable Energy Laboratory, U.S. Department of Energy, S. 108, abgerufen am 10. Oktober 2017.

