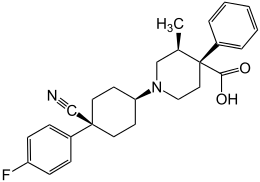
Levocabastin
Levocabastin ist ein Arzneistoff aus der Gruppe der H1-Antihistaminika der zweiten Generation. Es wird in Form von einer Suspension als Augentropfen und Nasenspray zur lokalen symptomatischen Behandlung allergischer Erkrankungen eingesetzt.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Freiname | Levocabastin | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C26H29FN2O2 | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||
| ATC-Code | ||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||
| Wirkmechanismus |
H1-Rezeptorantagonist | |||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 420,5 g·mol−1 | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Klinische Angaben
Anwendungsgebiete (Indikationen)
Levocabastin ist ein H1-Antihistaminikum, das ausschließlich topisch angewendet wird. Levocabastinhaltige Augentropfen und Nasensprays sind zur symptomatischen Behandlung der allergischen Konjunktivitis, einschließlich der Konjunctivitis vernalis (Frühjahrskatarrh), bzw. zur symptomatischen Behandlung der allergischen Rhinitis zugelassen.[2]
Gegenanzeigen (Kontraindikationen)
Bei einer bekannten Überempfindlichkeit gegen levocabastinhaltige Arzneimittel ist deren Anwendung kontraindiziert.[2]
Wechselwirkungen mit anderen Medikamenten
Bei bestimmungsgemäßer Anwendung sind kaum Wechselwirkungen mit anderen Medikamenten zu erwarten. Oxymetazolin-haltige Nasensprays können die Aufnahme von nasal verabreichtem Levocabastin vorübergehend verringern.[2]
Anwendung während Schwangerschaft und Stillzeit
Ein embryotoxisches oder teratogenes Potential konnte aus tierexperimentellen Studien nicht abgeleitet werden. Da nur begrenzte Daten von schwangeren Frauen vorliegen, gilt das Risiko für eine Schwangerschaft beim Menschen als weitgehend unbekannt.[2]
Der Übergang von nasal bzw. ophthal verabreichten Levocabastin in die Muttermilch ist begrenzt (etwa 0,6 bzw. 0,3 Prozent). Die Anwendung in der Stillzeit erfolgt nach einer Nutzen-Risiko-Abwägung.[2]
Unerwünschte Wirkungen (Nebenwirkungen)
Bei der Anwendung von Levocabastin-Augentropfen treten häufig (1 – 10 Prozent) Augenschmerzen und verschwommenes Sehen auf. Gelegentlich (0,1 – 1 Prozent) tritt ein Augenlidödem auf. Konjunktivitis, Augenschwellung, Blepharitis, oculare Hyperämie, tränende Augen, sonstige Beschwerden am Verabreichungsort, Angioödem, Überempfindlichkeit, Kontaktdermatitis, Urtikaria und Kopfschmerzen sind sehr selten (< 0,01 Prozent).[2]
Sehr häufig (< 10 Prozent) nach der Anwendung von Levocabastin-Nasensprays wurden Kopfschmerzen beobachtet. Häufig treten auch Übelkeit, Müdigkeit, Schmerzen, Sinusitis, Benommenheit, Schläfrigkeit, Schmerzen im Rachen-Kehlkopf-Bereich, Epistaxis (Nasenbluten) und Husten auf. Gelegentlich treten Angioödeme, Unwohlsein, Reizung, Schmerzen, Trockenheit am Verabreichungsort, Überempfindlichkeitsreaktionen, Dyspnoe, Nasenbeschwerden, nasale Kongestion und Bronchospasmus auf. Nebenwirkungen, wie Tachykardie, Brennen, Unbehagen am Verabreichungsort und Nasalödem sind selten (0,01 – 0,1 Prozent).[2]
Pharmakologische Eigenschaften
Wirkungsmechanismus (Pharmakodynamik)
Levocabastin ist ein H1-Rezeptorantagonist mit einer Selektivität gegenüber anderen Histamin- und Aminrezeptoren. Des Weiteren bindet Levocabastin an den Neurotensinrezeptor NTS2.
Aufnahme und Verteilung im Körper (Pharmakokinetik)
Die systemische Bioverfügbarkeit von Levocabastin nach Anwendung am Auge liegt bei etwa 30 bis 60 Prozent. Bei bestimmungsgemäßer Anwendung werden keine wirksamen Blutspiegel erreicht. Nach Anwendung in der Nase beträgt die systemische Bioverfügbarkeit 60 bis 80 Prozent. Die Plasmahalbwertzeit liegt bei 35 bis 40 Stunden. Systemisch aufgenommenes Levocabastin wird überwiegend über den Urin ausgeschieden.[2]
Einzelnachweise
- Datenblatt Levocabastine hydrochloride, ≥99% (HPLC), solid bei Sigma-Aldrich, abgerufen am 3. Januar 2013 (PDF).
- Fachinformation Livocab Kombi. McNeil. Stand März 2011.