Kulinkovich-Reaktion
Die Kulinkovich-Reaktion ist eine Namensreaktion der Organischen Chemie zur Herstellung von Cyclopropanol-Derivaten. Sie wurde 1989 von Kulinkovich et al. entwickelt.[1]
Übersicht
Als Edukte der Kulinkovich-Reaktion dienen ein Carbonsäureester, eine Grignard-Verbindung und ein Titan(IV)-alkoholat. Es bilden sich dabei in situ Titan-Reagenzien mit einem Wasserstoffatom in β-Position. Das Titan-Reagenz kann dabei in katalytischen Mengen verwendet werden.[2][3][4][5][6][7][8]
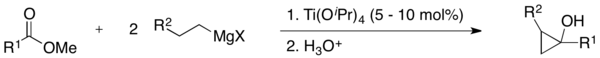
Als Titan-Katalysatoren können beispielsweise ClTi(OiPr)3, Ti(OiPr)4, ClTi(OtBu)3, Ti(OtBu)4 verwendet werden. Typische Lösungsmittel sind Et2O, THF oder Toluol. Tolerierte funktionelle Gruppen sind Ether R–O–R, Thioether R–S–R und Imine RN=CHR. Amide, primäre und sekundäre Amine und die meisten Carbamate werden unter den üblichen Reaktionsbedingungen nicht toleriert.
Reaktionsmechanismus
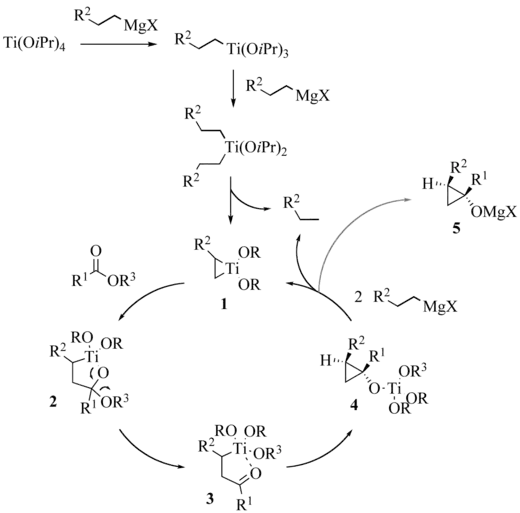
Der weitläufig akzeptierte Reaktionsmechanismus geht von zwei aufeinanderfolgenden Transmetallierungen mit Grignard-Reagenzien aus. Der entstandene Titanium-Komplex disproportioniert zu einem Alkan und Titanacyclopropan 1. Die Insertion der Carbonylgruppe des Esters in die schwächste Kohlenstoff-Titan Bindung gibt das Oxatitanacyclopentan 2, welches dann zum Keton 3 umlagern kann. Zuletzt schiebt sich die Carbonylgruppe von 3 nochmals in die verbleibende Kohlenstoff-Titan Bindung, wodurch das Cyclopropanol 4 gebildet wird. Die Stabilisation des Übergangszustand dieses Schrittes, welcher zugleich der geschwindigkeitslimitierende ist, durch eine agostische Wechselwirkung des β-Wasserstoffes und Titan wird als Grund für die beobachtet Diastereoselektivität vermutet. Transmetallierung von 4 führt zu dem großteils beobachteten Produkt 5 – ein Magnesiumalkoholat, aus welchem durch Hydrolyse das gewünschte Cyclopropanolat gebildet wird.
de-Meijere-Variante
Armin de Meijere et al. entwickelten eine Variante mit Amiden anstelle von Estern, wobei nun das Hauptprodukt ein Aminocyclopropan ist:[9][10]
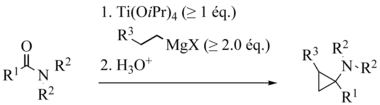 de Meijere variation
de Meijere variation
Intramolekulare Varianten sind auch bekannt:[11][12][13][14][15][16][17][18][19][20]
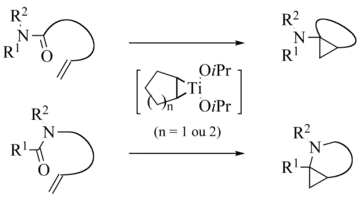 de Meijere variation intramolecular
de Meijere variation intramolecular
Szymoniak-Variante
In der von Szymoniak et al. entwickelten Variante ist das Substrat ein Nitril und das Hauptprodukt ein Cyclopropan mit einer primären Amingruppe:[21][9]
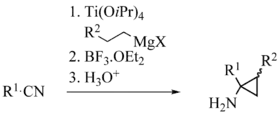 Szymoniak variation
Szymoniak variation
Der Reaktionsmechanismus ist analog zu dem der normalen Kulinkovich-Reaktion.
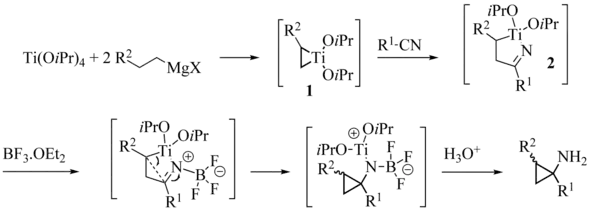 Szymoniak variation reaction mechanism
Szymoniak variation reaction mechanism
Einzelnachweise
- O. G. Kulinkovich, S. V. Sviridov, D. A. Vasilevskii, T. S. Pritytskaya: Zh. Org. Khim. 25, 1989, S. 2244.
- S. V. Sviridov, D. A. Vasilevski: Synthesis. 1991, S. 234.
- O. G. Kulinkovich, A. de Meijere: Chem. Rev. 100, 2000, S. 2789.
- F. Sato, H. Urabe, Okamoto: S. Chem. Rev. 100, 2000, S. 2835.
- Y.-D. Wu, Z.-X. Yu: J. Am. Chem. Soc. 123, 2001, S. 5777. doi:10.1021/ja010114q
- O. G. Kulinkovich Russ. Chem. Bull. No. 5, 2004, S. 1022–1043.
- A. Wolan, Y. Six: Tetrahedron. 66, 2010, S. 15–61.
- A. Wolan, Y. Six: Tetrahedron. 66, 2010, S. 3097–3133.
- V. Chaplinski, A. de Meijere: Angew. Chem. Int. Ed. Engl. 35, 1996, S. 413–414.
- A. de Meijere, H. Winsel, B. Stecker: Facile Synthesis of Aminocyclopropanes: N,N-Dibenzyl-N-(2-Ethenylcyclopropyl)amine In: Organic Syntheses. 81, 2005, S. 14, doi:10.15227/orgsyn.081.0014 (PDF).
- J. Lee, J. K. Cha: J. Org. Chem. 62, 1997, S. 1584–1585.
- V. Chaplinski, H. Winsel, M. Kordes, A. de Meijere: Synlett. 1997, S. 111–114.
- B. Cao, D. Xiao, M. M. Joullié: Org. Lett. 1, 1999, S. 1799–1801.
- H. B. Lee, M. J. Sung, S. C. Blackstock, J. K. Cha: J. Am. Chem. Soc. 123, 2001, S. 11322–13324.
- M. Gensini, S. I. Kozhushkov, D. S. Yufit, J. A. K. Howard, M. Es-Sayed, A. de Meijere: Eur. J. Org. Chem. 2002, S. 2499–2507.
- G.-D. Tebben, K. Rauch, C. Stratmann, C. M. Williams, A. de Meijere: Org. Lett. 5, 2003, S. 483–485.
- N. Ouhamou, Y. Six: Org. Biomol. Chem. 1, 2003, S. 3007–3009.
- M. Gensini, A. de Meijere: Chem. Eur. J. 10, 2004, S. 785–790.
- L. Larquetoux, J. A. Kowalska, Y. Six: Eur. J. Org. Chem. 2004, S. 3517–3525.
- L. Larquetoux, N. Ouhamou, A. Chiaroni, Y. Six: Eur. J. Org. Chem. 2005, S. 4654–4662.
- P. Bertus, J. Szymoniak: Chem. Commun. 2001, S. 1792–1793.