Kaliumazid
Kaliumazid ist das Kaliumsalz der Stickstoffwasserstoffsäure und gehört damit zur Gruppe der Azide.
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
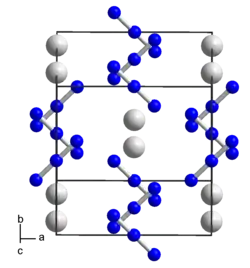 | ||||||||||||||||
| _ K+ _ N1/3− | ||||||||||||||||
| Kristallsystem |
tetragonal | |||||||||||||||
| Raumgruppe |
I4/mcm (Nr. 140) | |||||||||||||||
| Gitterparameter |
a = 6,1129 Å, c = 7,0943 Å | |||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Kaliumazid | |||||||||||||||
| Verhältnisformel | KN3 | |||||||||||||||
| Kurzbeschreibung |
farbloser Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 81,12 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[2] | |||||||||||||||
| Dichte |
2,038 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Gewinnung und Darstellung
Kaliumazid kann durch Reaktion von Stickstoffwasserstoffsäure und Kaliumhydroxid gewonnen werden.[5]
Es kann auch durch Reaktion von Kaliumcarbonat mit Stickstoffwasserstoffsäure gewonnen werden.[3]
Beschreibung und Eigenschaften
Kaliumazid ist eine sehr giftige Chemikalie, die zudem bei Einwirkung von ultraviolettem Licht oder bei starker Erhitzung explosiv reagiert. Sie disproportioniert hierbei zu metallischem Kalium und Stickstoffgas. Kaliumazid ist nicht schlagempfindlich wie etwa Schwermetallazide.[6] Die Reaktion läuft folgendermaßen ab:[7]
Es kristallisiert in einer tetragonalen Kristallstruktur mit der Raumgruppe I4/mcm (Raumgruppen-Nr. 140) und Z=4.[7] mit den Gitterkonstanten a = 6,1129 Å und c = 7,0943 Å.[8]
Siehe auch
Einzelnachweise
- Roger Blachnik (Hrsg.): Taschenbuch für Chemiker und Physiker. Band III: Elemente, anorganische Verbindungen und Materialien, Minerale. begründet von Jean d’Ans, Ellen Lax. 4., neubearbeitete und revidierte Auflage. Springer, Berlin 1998, ISBN 3-540-60035-3, S. 510 (eingeschränkte Vorschau in der Google-Buchsuche).
- Datenblatt Potassium azide, ≥99.9% trace metals basis bei Sigma-Aldrich, abgerufen am 18. März 2013 (PDF).
- Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 458.
- EPA TSCA Chemical Substance Inventory: Section 8(b), Potassium azide; 1998.
- Inorganic Syntheses. John Wiley & Sons, 2009, ISBN 0-470-13264-7, S. 79 (eingeschränkte Vorschau in der Google-Buchsuche).
- Pradyot Patnaik: A Comprehensive Guide to the Hazardous Properties of Chemical Substances. John Wiley & Sons, 2007, ISBN 978-0-471-71458-3, S. 615 (eingeschränkte Vorschau in der Google-Buchsuche).
- C. C. Addison: Inorganic Chemistry of the Main-Group Elements. Royal Society of Chemistry, 1974, ISBN 0-85186-762-6, S. 54 (eingeschränkte Vorschau in der Google-Buchsuche).
- Ulrich Müller: Verfeinerung der Kristallstrukturen von KN3, RbN3, CsN3 und TlN3. In: Zeitschrift für anorganische und allgemeine Chemie. Band 392, Nr. 2, 1972, S. 159–166, doi:10.1002/zaac.19723920207.
