Hypomanganate
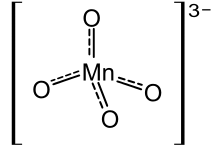
Hypomanganate oder Manganate(V) sind chemische Verbindungen des Mangans mit dem MnO43−-Anion. Sie sind instabil und disproportionieren leicht zu Mangan(IV)-oxid und Permanganaten. Typisch ist die blaue Farbe des Hypomanganat-Ions.
Gewinnung und Darstellung
Hypomanganate lassen sich durch Oxidation von Mangan(IV)-oxid mit Natriumoxid in einer Natriumnitrit-Schmelze darstellen.
Ebenfalls möglich ist eine Reduktion von Permanganaten oder sechswertigen Manganaten mit Sulfiten in basischer Umgebung.
Eigenschaften
Durch das MnO43−-Ion sind Hypomanganate charakteristisch blau gefärbt. Dieses ist zudem paramagnetisch.
Der pKs-Wert der hypothetischen Hypomangansäure beträgt in der 3. Protolysestufe für die Reaktion von [O3Mn(OH)]2− zu MnO43− 13,7, die der anderen Protolysestufen sind unbekannt, da sich Hypomanganate in saurer Lösung schnell zersetzen und nur in basischer Lösung stabil sind.[1]
Verwendung
Hypomanganate haben keine technische Bedeutung. Sie sind kurzlebige, nicht isolierbare Zwischenprodukte bei der Herstellung von Kaliumpermanganat.
In Oxidationsschmelzen zum Mangan-Nachweis bildet sich bei geringer Sauerstoffzufuhr Hypomanganat anstatt des grünen Manganats.[2]
Einzelnachweise
- J. D. Rush, B. H. J. Bielski: Studies of Manganate(V), -(VI), and -(VII) Tetraoxyanions by Pulse Radiolysis. Optical Spectra of Protonated Forms. In: Inorganic Chemistry. 34, 1995, S. 5832–5838, doi:10.1021/ic00127a022.
- J. Strähle, E. Schweda: Jander · Blasius – Einführung in das anorganisch-chemische Praktikum. 14. Auflage, S. Hirzel Verlag, Stuttgart 1995, ISBN 978-3-77-760672-9, S. 186–192.
Literatur
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1617.