Hydroxyethylstärke
Hydroxyethylstärke, abgekürzt HES oder HAES (früher auch: HÄS), ist ein künstlich hergestelltes Polymer. Es wird als kolloidaler Volumenersatz – wie auch Dextrane und Gelatine – zum Ausgleich eines intravaskulären Volumenmangels eingesetzt.
Nachdem HES über viele Jahre umfangreich eingesetzt wurde, wird die Verwendung wird heute kritisch gesehen. Aufgrund von Studien zum Nutzen-Risiko-Verhältnis empfahl der Pharmakovigilanzausschuss (Pharmacovigilance Risk Assessment Committee, PRAC) der Europäischen Arzneimittel-Agentur (European Medicines Agency) mehrfach, zuletzt im Februar 2022, die Aussetzung der Marktzulassung für Produkte, die Hydroxyethylstärke enthalten.
Die US-amerikanische Food and Drug Administration gab am 24. Juni 2013 eine Black-Box-Warnung für HES heraus.[1]
Eigenschaften der HES-Blutplasmaersatzstoffe
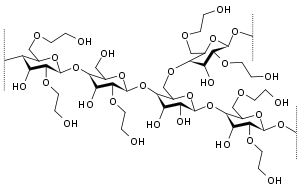
Hergestellt wird HES aus Wachsmaisstärke oder aus Kartoffelstärke. Damit besteht sie fast ausschließlich aus Amylopektin, also aus verzweigten Ketten von Glucosemolekülen. Um einen zu schnellen Abbau des Amylopektins durch das endogene Enzym Amylase zu verhindern, erfolgt eine teilweise Hydroxyethylierung der Glucoseeinheiten. Diese Hydroxyethylierung ist auch notwendig um eine Wasserlöslichkeit von Stärke zu erreichen.
Waren in der ersten Generation die durchschnittliche Molekülgröße meist 450.000 Dalton und der Substitutionsgrad betrug 0,7, so reduzierten sich diese in der zweiten Generation auf 200.000 und 0,5 und in der dritten Generation auf 130.000 und 0,4. In den USA ist weiterhin nur die erste Generation als Hetastarch verfügbar, während die zweite Generation als Pentastarch nur bestimmten Anwendungen vorbehalten bleibt. Heutige moderne HES haben neben einer weiter reduzierten molaren Masse von ca. 130.000 mit einem Substitutionsgrad von 0,4 auch nicht mehr Kochsalzlösung zur Aufrechterhaltung der Isotonie, sondern eine balancierte Lösung mit Acetat.
Wirkungsmechanismus
HES ist ein großmolekularer Stoff und in der Lage, den kolloidosmotischen Druck in der Blutbahn zu erhalten, sodass der Flüssigkeitsverlust bis zu einem gewissen Grad ausgeglichen werden kann und die gegebene Flüssigkeit länger in der Blutbahn verbleibt, als rein kristalloide Infusionen dies tun würden.
Die Wirkungsweise von HES basiert auf dem Prinzip der Kolloidosmose. Im Blut herrscht unter Normalbedingungen ein bestimmter onkotischer Druck (kolloidosmotischer Druck). Albumine (als Kolloide) im Blut sind hochmolekulare Eiweiße und sorgen dafür, dass die Flüssigkeit im Blut bleibt. Kommt es zu einem Volumenmangel, etwa durch einen Schock, ist das Gleichgewicht aufgehoben, die Flüssigkeit geht aus der Blutbahn in das Gewebe über. Die Gabe einer kolloidalen Lösung wirkt dem entgegen, indem Flüssigkeit in das intravasale Lumen gezogen wird, wobei es aber zu einem Flüssigkeitsmangel im Gewebe (Interstitium) kommen kann. Deshalb ist meist zusätzlich die Gabe einer Vollelektrolytlösung nötig.
Anwendung als Volumenersatzmittel
HES gehörte viele Jahre zur Grundausstattung eines jeden Rettungswagens. Die Wahl der Infusionslösung beim akuten Notfallereignis – ob kristalloide, kolloidale oder hypertone NaCl-Lösungen – wurde jedoch bereits länger kontrovers diskutiert. Seit 2013 ist die Anwendung von HES nur noch bei akuter, nicht anders zu behandelnder Blutung erlaubt. Für andere Indikationen ist es nicht mehr zugelassen.
Die Gabe erfolgt seitdem nur noch in begründeten Einzelfällen. Zusätzlich zu HES muss bei einem Mangel an interstitieller Flüssigkeit auch eine Vollelektrolytlösung (früher etwa Ringerlösung, heutzutage mit Acetat) gegeben werden, um den gesamten Flüssigkeitsmangel auszugleichen. Zwar benötigt man mit Kristalloiden für einen Volumenersatz eine größere Menge von Kolloid-Infusionen, wie z. B. HES, jedoch können damit deren unerwünschte Wirkungen vermieden werden. So wird die Anwendung von HES-Infusionen bei Verbrennungspatienten in den ersten 24 Stunden kritisch beurteilt und die alleinige Infusion von Ringer-Laktat oder einer Elektrolytlösung favorisiert, denn die kolloidale HES-Lösung kann durch Ablagerungen im Interstitium das Verbrennungsödem verstärken.
Unerwünschte Wirkungen
Nach Gabe von HES kann nach einigen Tagen ein Juckreiz der Haut (Pruritus) auftreten. Bedingt wird dieser vermutlich durch eine Anreicherung von HES in der Haut. Sie ist häufig sehr schwer zu behandeln und kann mehrere Monate andauern.[2]
Eine alleinige Gabe von größeren Mengen HES ohne zusätzliche andere Flüssigkeit könnte zu einer erhöhten Konzentration in den Nierenkanälchen und durch die Osmose zum Nierenschaden führen. Deswegen muss HES immer mit ausreichend kristalloiden Infusionen kombiniert werden.[3] Das erhöhte Risiko für ein Nierenversagen und auch letale Folgen der Nierenschädigung wurden 2013 in zwei weiteren großen Studien bestätigt.[4][5]
Zu der Wirksamkeit und den Indikationen von HES in der Sepsis wurde 2008 die VISEP-Studie erstellt.[6] Die Aussagen dieser Studie beziehen sich jedoch auf HES-Varianten der zweiten Generation (200, 0.4). Zum Einsatz moderner, niedermolekularer HES-Lösungen empfahl die DGAI damals vorsorglich, den Einsatz von HES in jedem Einzelfall kritisch abzuwägen und auf Patienten mit akut vitalbedrohlichen, anderweitig nicht beherrschbaren Blut und Volumenverlusten zu beschränken.
In einer Studie des dänischen Rigshospitalet in Kopenhagen im Jahr 2012, unter der Leitung von Andres Perner mit dem HES-Produkt der Firma B.Braun hatten Perner und ein Team skandinavischer Forscher Nutzen und Risiko des künstlichen Blutplasmas Hydroxyethylstärke (HES) in der Behandlung einer schweren Blutvergiftung untersucht. Die Studie ergab, dass Patienten mit einer Sepsis, bei denen ein Teil des Flüssigkeitsverlusts durch HES-Infusionen ausgeglichen wird, ein höheres Sterberisiko hatten als jene, die eine isotonische Lösung erhielten. Auch kam es bei HES-Patienten häufiger zu Nierenschäden und schweren Blutungen.[7] Der HES-Hersteller Fresenius Kabi wurde für seine aggressive Vorgehensweise gegen die missverständliche Nennung seines Produktnamens in der Studie unter Einsatz juristischer Mittel nach Veröffentlichung der Studienergebnisse kritisiert.[8] Die Presse berichtete 2012, dass auch schon einer früheren Cochrane-Studie zufolge es keine Hinweise gebe, dass Substanzen wie HES das Sterberisiko von Patienten nach Trauma, Operation oder schweren Verbrennungen verringerten. Zudem wurde bekannt, dass mehrere Ergebnisse aus Studien zu HES gefälscht worden waren.[9] Der deutsche Anästhesiologe Joachim Boldt hatte rund 70 Fachartikel über Hydroxyethylstärke veröffentlicht, meist mit positiver Bewertung des Medikaments.[10] Dies entspricht 0,68 % der Gesamtliteratur zu HES.[11] Die Herausgeber von 16 internationalen Fachzeitschriften zogen zahlreiche Veröffentlichungen Boldts zurück, nachdem eine Analyse der Landesärztekammer Rheinland-Pfalz ergeben hatte, dass bei 89 von insgesamt 102 Studien keine Genehmigung der Ethikkommissionen nachweisbar war.[12] (siehe auch: Betrug und Fälschung in der Wissenschaft)
Der Pharmakovigilanzausschuss für Risikobewertung (Pharmacovigilance Risk Assessment Committee, PRAC) der Europäischen Arzneimittel-Agentur (European Medicines Agency) empfahl nach einem Risikobewertungsverfahren im Juni 2013 das Aussetzen der Marktzulassung für Produkte, die Hydroxyethylstärke enthalten,[13] dem die britische Medicines and Healthcare products Regulatory Agency wenige Tage später folgte.[14] Das deutsche Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) hingegen empfahl, bis zum offiziellen Abschluss des Verfahrens „von der Anwendung hydroxyethylstärkehaltiger Infusionslösungen abzusehen“.[15]
Die US-amerikanische Food and Drug Administration gab im Juni 2013 eine Black-Box-Warnung für HES heraus, in der vor dem Einsatz von HES bei kritischen Erkrankungen, wie Sepsis, Nierenfunktions- und Gerinnungsstörungen, sowie auf Intensivstationen gewarnt wird, da es zu Störungen der Nierenfunktion und zu starken Blutungen kommen kann.[1]
Im Oktober 2013 folgte in einem getrennten Verfahren eine weitere Empfehlung des PRAC: HES sollte nicht mehr angewendet werden bei Patienten mit einer Sepsis, Patienten mit Verbrennungen und kritisch kranken Patienten.[16][17]
HES sollte nicht über einen Zeitraum von mehr als 24 Stunden angewandt werden, und die Nierenfunktion für mindestens 90 Tage überwacht werden.[18]
Im Februar 2017 forderte die Public citizen.org, eine Consumer watch Organisation, im Rahmen einer Citizen Petition an die FDA und EMA erneut ein Verbot von HES.[19]
Es kam zu einem dritten Bewertungsverfahren durch den PRAC. Das im Januar 2018 veröffentlichte Ergebnis besagte, dass die Anwendungsbeschränkungen und Kontraindikationen im Bereich der Intensivmedizin nicht eingehalten würden. Obwohl der PRAC daher empfahl, alle HES-Zulassungen europaweit auszusetzen und die Produkte vom Markt zu nehmen,[20] folgte die für die Umsetzung zuständige Koordinierungsgruppe der Mitgliedstaaten (CMDh) bei der Heads of Medicines Agencies (HMA) dem nicht, sondern empfahl lediglich eine weitere Beschränkung der Verwendung. Die Europäische Kommission entschied im Juli 2018 rechtlich bindend: Die Verwendung von HES-Infusionslösungen sei auf akkreditierte Krankenhäuser zu beschränken, und Angehörige der Gesundheitsberufe, die die Arzneimittel verschreiben oder verabreichen, müssten in der Anwendung geschult werden. Unternehmen, die HES-Infusionslösungen vermarkten, wurden aufgefordert, eine Studie zur Wirkstoffverwendung durchzuführen, um zu überprüfen, ob die Einschränkungen in der klinischen Praxis eingehalten wurden, und die Ergebnisse dieser Studie der EMA vorzulegen.[21][22]
Der PRAC hat die Ergebnisse dieser Studie überprüft, die zeigten, dass HES-Infusionslösungen nach wie vor außerhalb der Empfehlungen in den Produktinformationen verwendet werden. Angesichts der ernsten Risiken, denen bestimmte Patientenpopulationen nach wie vor ausgesetzt sind, hat der PRAC im Februar 2022 erneut empfohlen, die Genehmigungen für das Inverkehrbringen von HES-Infusionslösungen in der EU auszusetzen.[23]
HES als Dopingsubstanz im Leistungssport
Zweifelhafte Berühmtheit erlangte HES durch zudem den Dopingskandal an der Nordischen Skiweltmeisterschaft 2001 im finnischen Lahti. Damals wurde sechs finnischen Langläufern, unter anderem dem Olympiasieger und mehrfachen Weltmeister Mika Myllylä, die Einnahme von HES nachgewiesen, nachdem das Mittel erst ein Jahr zuvor auf die Dopingliste des IOC gesetzt worden war, wahrscheinlich um den durch EPO-Doping oder Blutdoping gestiegenen Hämatokritwert und die damit erhöhte Blutviskosität durch die positiv rheologischen Eigenschaft[24] von HES zu kompensieren. Die leistungssteigernde Wirkung von HES selber ist unter Fachleuten umstritten.
Einzelnachweise
- FDA Safety Communication: Boxed Warning on increased mortality and severe renal injury, and additional warning on risk of bleeding, for use of hydroxyethyl starch solutions in some settings. Mitteilung der Food and Drug Administration vom 24. Juni 2013.
- K. Aktories, U. Förstermann, F. Hofmann, K. Starke (Hrsg.): Allgemeine und spezielle Pharmakologie und Toxikologie. 9. Auflage. Elsevier, München 2005, ISBN 3-437-42521-8, S. 489.
- Vgl. H. Köhler: Einfluss der Nierenfunktion auf die Elimination und Wirkung von kolloidalen Plasma-Ersatzmitteln. In: Fortschritte der Medizin. Band 97, 1979, S. 1809–1813.
- R. Zarychanski, A. M. Abou-Setta, A. F. Turgeon u. a.: Association of Hydroxyethyl Starch Administration With Mortality and Acute Kidney Injury in Critically Ill Patients Requiring Volume Resuscitation: A Systematic Review and Meta-analysis. In: JAMA. 309, 2013, S. 678–688, doi:10.1001/jama.2013.430
- N. Haase, A. Perner, L. I. Hennings, M. Siegemund, B. Lauridsen, M. Wetterslev, J. Wetterslev: Hydroxyethyl starch 130/0.38-0.45 versus crystalloid or albumin in patients with sepsis: systematic review with meta-analysis and trial sequential analysis. In: BMJ. 346, 2013, S. 346, doi:10.1136/bmj.f839
- K. Reinhart u. a.: Studienprotokoll der VISEP-Studie – Entgegnung der SepNet-Studiengruppe. In: Der Anaesthesist. 57, 2008, S. 723–728, doi:10.1007/s00101-008-1391-1. (online, PDF-Dokument; 299 kB)
- Anders Perner u. a.: Hydroxyethyl Starch 130/0.42 versus Ringer’s Acetate in Severe Sepsis. In: N Engl J Med. 367, 2012, S. 124–134, doi:10.1056/NEJMoa1204242
- Nicola Kuhrt: Umstrittenes Notfallmittel: Pharmakonzern bedrängt kritische Forscher. In: Spiegel Online. 27. Juli 2012.
- Kai Kupferschmidt: Notfallmedizin: Tod am Tropf. In: Zeit online. vom 23. Oktober 2012.
- Veronika Hackenbroch: Zu schön, um wahr zu sein. In: Spiegel Online. 29. November 2010. (online)
- Muss der klinische Einsatz moderner Hydroxyethylstärke-Lösungen gegenwärtig neu bewertet werden? Stellungnahme des Präsidiums der DGAI vom 21. Februar 2011. In: Anästh Intensivmed. 52, 2011, S. 173. (online (Memento vom 19. Dezember 2013 im Internet Archive), PDF-Dokument; 386 kB)
- Stellungnahme der Herausgeber (PDF-Dokument; 139 kB)
- Ausschuss für Risikobewertung im Bereich der Pharmakovigilanz (Pharmacovigilance Risk Assessment Committee, PRAC) der Europäischen Arzneimittel-Agentur (European Medicines Agency) PRAC recommends suspending marketing authorisations for infusion solutions containing hydroxyethyl-starch. 14. Juni 2013, Pressemitteilung, PDF (71 kB).
- MHRA suspends use of hydroxyethyl starch (HES) drips. (Memento vom 10. August 2014 im Webarchiv archive.today) Pressemitteilung der Medicines and Healthcare products Regulatory Agency vom 27. Juni 2013.
- Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM): Hydroxyethylstärke (HES): Empfehlung des PRAC. (Memento vom 1. Juli 2013 im Webarchiv archive.today) Mitteilung vom 24. Juni 2013.
- EMA: Hydroxyethyl-starch solutions (HES) should no longer be used in patients with sepsis or burn injuries or in critically ill patients – CMDh endorses PRAC recommendations. EMA Mitteilung
- Hes: EU-Behörde beschränkt Einsatz von umstrittenem Blutersatz. In: Spiegel Online. 11. Oktober 2013.
- Pharmakovigilanzausschuss für Risikobewertung (Pharmacovigilance Risk Assessment Committee, PRAC) der Europäischen Arzneimittel-Agentur (European Medicines Agency) PRAC confirms that hydroxyethyl-starch solutions (HES) should no longer be used in patients with sepsis or burn injuries or in critically ill patients. 11. Oktober 2013, Pressemitteilung. (PDF)
- Public Citizen Petitions FDA to Pull Some IV Solutions. vom 8. Februar 2017
- HES-Zulassungen sollen ausgesetzt werden Julia Borsch, DAZ.online vom 12. Januar 2018, abgerufen am 14. Januar 2018
- Hydroxyethyl starch (HES) containing medicinal products. European Medicines Agency (EMA), Juli 2018
- https://www.bfarm.de/SharedDocs/Downloads/DE/Arzneimittel/Pharmakovigilanz/Risikoinformationen/RisikoBewVerf/g-l/hes-stufenplanbescheid.pdf?__blob=publicationFile&v=2
- PRAC recommends suspending hydroxyethyl-starch solutions for infusion from the market, EMA, 11. Februar 2022.
- Karow, Lang-Roth: Allgemeine und Spezielle Pharmakologie und Toxikologie.