Hydroxydanaidal
Hydroxydanaidal ist ein Insektenpheromon, das von manchen Schmetterlingen durch Umwandlung von mit der Nahrung aufgenommenen Pyrrolizidinalkaloidvorstufen synthetisiert wird.
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
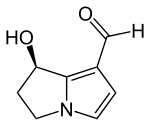 | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Hydroxydanaidal | ||||||||||||
| Andere Namen |
7-Hydroxy-6,7-dihydro-5H-pyrrolizin-1-carboxaldehyd | ||||||||||||
| Summenformel | C8H9NO2 | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 151,16 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest | ||||||||||||
| Schmelzpunkt |
55 °C[1] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Verwendung
Die Raupen mancher Bärenspinnerarten nehmen Pyrrolizidinalkaloide, eigentlich Schutzsubstanzen von Pflanzen gegen Pflanzenfresser, mit der Nahrung auf und nutzen diese als Schutzsubstanz gegen Insektenfresser. Die Raupe wandelt die Alkaloide in die entsprechenden N-Oxide um, die gespeichert werden. Bei der Metamorphose gehen die Alkaloide nicht verloren und stehen dem erwachsenen Tier als Fraßschutz zur Verfügung.[3] Es ist beobachtet worden, wie Bärenspinner der Art Utetheisa ornatrix, die in Spinnennetzen gefangen wurden, durch die Spinne wieder freigeschnitten wurden.[4] Viele Insekten, die Pyrrolizidinalkaloide aufnehmen, sind aposematisch gefärbt, um ihre Giftigkeit zu signalisieren.
Männliche Bärenspinner wandeln die Pyrrolizidinalkaloide über verschiedene Zwischenstufen in das Insektenpheromon Hydroxydanaidal um. Da der Gehalt des männlichen Pheromons mit dem Gehalt an aufgenommenen Pyrrolizidinalkaloiden steigt, und diese auch vom Männchen als Fraßschutz an den Nachwuchs weitergegeben werden können, bevorzugen Weibchen Partner mit hohen Hydroxydanaidalgehalten.[5][6]
Einzelnachweise
- RÖMPP Lexikon Naturstoffe, 1. Auflage, 1997, 735 Seiten, Verlag Thieme, Stuttgart (1997), ISBN 978-3137499015, S. 170.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Michael Boppre: Pharmakophagie: Drogen, Sex und Schmetterlinge. In: Biologie in unserer Zeit. 25, 1995, S. 8–17, doi:10.1002/biuz.19950250103.
- Klaus Roth: Die Chemie eines kleinen Spinners. In: Chemie in unserer Zeit. 39, 2005, S. 72–76, doi:10.1002/ciuz.200590010.
- S. Schulz u. a.: Insect pheromone biosynthesis: stereochemical pathway of hydroxydanaidal production from alkaloidal precursors in Creatonotos transiens (Lepidoptera, Arctiidae). In: Proceedings of the National Academy of Sciences, 90.14, 1993, S. 6834–6838.
- John A. Edgar, Michael Boppre, Eva Kaufmann: Insect-synthesised Retronecine Ester Alkaloids: Precursors of the Common Arctiine (Lepidoptera) Pheromone Hydroxydanaidal. In: Journal of Chemical Ecology. 33, 2007, S. 2266–2280, doi:10.1007/s10886-007-9378-y.