Histidinkinasen
Histidinkinasen (auch Protein-Histidinkinasen genannt) sind Enzyme, die Histidinreste in Proteinen phosphorylieren. Sie sind Teil von Signaltransduktionskaskaden, das heißt, sie registrieren Signale und lösen dann eine für dieses Signal spezifische Reaktion aus. Histidinkinasen kommen sowohl in Prokaryoten (also Archaebakterien und Eubakterien), in Pilzen als auch im Pflanzenreich vor. Nur in Tieren einschließlich des Menschen – außer in den Mitochondrien – wurden bis heute keine Histidinkinasen entdeckt. Sie weisen sehr viele Gemeinsamkeiten mit Serinkinasen auf.
| Histidinkinasen | ||
|---|---|---|
| Enzymklassifikation | ||
| EC, Kategorie | 2.7.13.-, Kinase | |
| Substrat | ATP + Protein-L-Histidin | |
| Produkte | ADP + Protein-N-Phospho-L-Histidin | |
Die Wirkungsweise von Histidinkinasen ist in zwei Systeme unterteilt:
- das Zwei-Komponenten-Histidinkinase-System
- das Phosphorelay-System.
Das Zwei-Komponenten-Histidinkinase-System
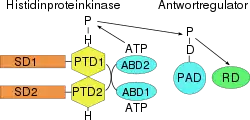
Das Zwei-Komponenten-Histidinkinase-System ist einer der einfachsten Signaltransduktionswege. Er beruht auf zwei Enzymen, einer Histidinkinase und einem Antwortregulator. Die Histidinkinase besteht immer aus zwei gleichen Einheiten (Monomeren) und wird daher als Homodimer bezeichnet. Sie besitzt im Allgemeinen drei Domänen:
- eine Sensordomäne,
- eine Phosphotransferdomäne und
- eine ATP-Bindedomäne.
Der Antwortregulator ist ein Protein, das aus zwei Domänen besteht:
- einer Phosphoakzeptordomäne und
- einer Regulatordomäne.
Bei der Signaltransduktion wird ein Signal durch die Sensordomäne gebunden. Anschließend wird das ATP der ATP-Bindedomäne zu Adenosindiphosphat (ADP) hydrolysiert, welches nicht mehr von der ATP-Bindedomäne gebunden werden kann. Es wird durch ein frisches ATP ersetzt. Das bei der Hydrolyse freigesetzte Phosphat wird auf ein spezielles Histidin in der Phosphotransferdomäne übertragen. Dabei stammt das Phosphat vom jeweils am anderen Monomer gebundenen ATP. Demzufolge handelt es sich strikt genommen nicht um eine reine Autophosphorylierung, denn es wird das andere Monomer phosphoryliert. Das so entstandene phosphorylierte Histidin besitzt ein hohes Phosphorylgruppenübertragungspotential, d. h., es kann das Phosphat sehr leicht und ohne weitere ATP-Hydrolyse auf andere Aminosäuren übertragen. So wird dieses Phosphat auf ein spezifisches Aspartat in der Phosphoakzeptordomäne des Antwortregulators transferiert. Die Histidinkinase und der Antwortregulator müssen sich für diese Reaktion in räumlicher Nähe befinden. Durch die Phosphorylierung des Antwortregulators ändert dieser die räumliche Anordnung seiner Aminosäuren. Es kommt also zu einer sogenannten Konformationsänderung. Dadurch wird das aktive Zentrum des Antwortregulators freigelegt, welches nun seine Funktion ausführen kann.
Das Zwei-Komponenten-Histidinkinase-System ist fast ausschließlich im prokaryotischen Reich anzutreffen, seltener bei Eukaryoten. Es ist in sehr viele wichtige Stoffwechselprozesse eingegliedert, wie zum Beispiel die Erkennung von bestimmten chemischen Stoffen bei Escherichia coli, die u. a. von Bedeutung für die Chemotaxis ist.
Das Phosphorelay-System
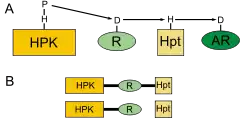
Das Phosphorelay-System stellt eine komplexere Variante des Zwei-Komponenten-Histidinkinase-Systems dar. Es besteht nicht nur aus einer Histidinkinase und einem Antwortregulator, sondern zusätzlich noch aus einem Regulator- und einem Phosphotransferprotein. Dabei werden die Stufen der Phosphorylierung zweimal durchlaufen. Dies beinhaltet eine Phosphorylierung eines Histidins der Histidinkinase, gefolgt von der Übertragung auf das Regulatorprotein und der anschließenden Phosphorylierung eines zweiten Histidins, das dieses Mal im Phosphotransferprotein zu finden ist. Diese Phosphorylierung benötigt Energie, die durch die Hydrolyse eines weiteren ATP-Moleküls bereitgestellt wird. Im letzten Schritt wird das Phosphat auf den Antwortregulator übertragen. Durch die nötige räumliche Nähe für diese Reaktionen sind häufig die Histidinkinase und Regulatorprotein, manchmal auch das Phosphotransferprotein, evolutionsbedingt miteinander fusioniert (Hybridprotein). Das ist in der Abbildung Teil B zu erkennen. Das Phosphorelay ist häufiger bei Eukaryoten zu finden als bei Prokaryoten. Genau wie das Zwei-Komponenten-Histidinkinase-System ist das Phosphorelay an wichtigen Stoffwechselprozessen beteiligt, wie zum Beispiel der Sporulation von Bacillus subtilis.
Vielfalt in Funktion und Anzahl von Histidinkinasen
Wie schon erwähnt sind Histidinkinasen an sehr vielen Stoffwechselprozessen beteiligt, wie z. B.:
- bei einigen Pilzen an der Synthese von Antibiotika,
- bei Bakterien am Stickstoffhaushalt und der Chemotaxis (Escherichia coli),
- bei Arabidopsis an der Ethylenrezeption und dient auch als Cytokinin-Rezeptor (Hybridkinase)
- bei Hefe (Saccharomyces cerevisiae) an der Osmoregulation oder
- bei Symbiosen und der Knöllchenbildung.
Die Anzahl an Histidinkinasen im Genom verschiedener Organismen ist nicht immer gleich. Sie variiert von keiner (Mycoplasma genitalium) bis zu über 30 (z. B. in E. coli). Über die Korrelation, also den Zusammenhang, der Anzahl an Histidinkinasen und der Lebensweise der Organismen gibt es nur Spekulationen. Zum Beispiel wird vermutet, dass Arten, die beständig starken Änderungen ihrer Umgebung ausgesetzt sind (wie bei E. coli der Fall: es lebt bzw. überlebt im Blutplasma, im Darm, im Abwasserkanal etc.), auch über mehr Histidinkinasen verfügen als Organismen, die in konstanten Milieus leben.
Allgemeiner Aufbau der Histidinkinasen
Proteine werden stets vom N-Terminus zum C-Terminus beschrieben, so auch die Histidinkinasen. Am N-Terminus befindet sich die oben schon erwähnte Sensordomäne. Sie kann aus verschiedenen konservierten Motiven bestehen. Unter konservierten Motiven versteht man die gleiche oder meist auch nur ähnliche Abfolge verschiedener Aminosäuren in der Sequenz mehrerer Proteine. Dabei wird mehr Wert auf die Eigenschaften der Aminosäuren gelegt, wie Hydrophobizität oder Ladung. Es gibt unzählige solcher Motive. In der Sensordomäne vieler Histidinkinasen findet man die sogenannten GAF-, PAS- und HAMP-Motive sowie Transmembrandomänen. Diese Domäne bzw. Motive können unterschiedliche Signale erkennen und sind unter anderem für die Vielfalt der Histidinkinasen verantwortlich.
Die Phosphotransfer- und die ATP-Bindedomäne sind viel stärker konserviert. Das heißt, Histidinkinasen aus den unterschiedlichsten Organismen, auch wenn sie evolutionär sehr weit voneinander entfernt sind, besitzen eine sehr große Ähnlichkeit wenn nicht gar identische Aminosäurensequenz in diesem Bereich. So wurden diese Domänen in verschiedene Motive aufgrund ihrer Funktion untergliedert. Die Motive sind in der folgenden Tabelle aufgeführt. Die großen Buchstaben kennzeichnen Aminosäuren nach dem Einbuchstabencode. Das kleine h steht für irgendeine hydrophobe Aminosäure und das x für eine x-beliebige. Die vielen nicht konservierten Aminosäuren bedeuten einfach, dass die speziellen Aminosäuren einen definierten Abstand zueinander besitzen.
| H-Box | F-h-x-x-h-(S/T/A)-H-(D/E)-h-(R/K)-T-P-L-x-x-h | |
| X-Box | viele hydrophobe Aminosäuren | |
| N-Box | (D/N)-x-x-x-h-x-x-h-h-x-N-L-h-x-N-A-h-x-(F/H/Y)-(S/T) | |
| D- und F-Box | h-x-h-x-h-x-D-x-G-x-G-h-x-x-x-x-x-x-x-h-F-x-x-F | |
| G-Box | G-G-x-G-L-G-L-x-h-h-x-x-h-h-x-x-x-x-G-x-h-x-h-x-x-x-x-G-x-x-F |
Die H-Box ist nach der funktionell hier wichtigen Aminosäure Histidin benannt, welches phosphoryliert wird. Die X-Box ist für die Dimerisation zuständig, das heißt, sie bindet das andere Monomer. Die N-Box bildet eine Tasche, durch die das Phosphat vom ATP zum Histidin geleitet wird. Die D-Box bindet das ATP über elektrostatische Wechselwirkungen, während die G-Box eine Art Deckel auf dem ATP bildet.
Literatur
- Grebe, T. W.; Stock, J. B.: The Histidine Protein Kinase Superfamily. Adv. Micr. Phys. 41 (1999), 139–224
- Hoch, J. A.: Two-component and phosphorelay signal transduction. Curr. Opin. in Microbiol. 3 (2000), 165–170
- Catlett, N. L.; Yoder, O. C.; Turgeon, B. G.: Whole-Genome Analysis of Two-Component Signal Transduction Genes in Fungal Pathogens. Eukar. Cell 2 (2003), 1151–1161