Henkel-Reaktion
Die Henkel-Reaktion ist eine Namensreaktion aus dem Bereich der Organischen Chemie, die 1952 erstmals durch den deutschen Chemiker Bernhard Raecke (Henkel & Cie. GmbH) publiziert wurde.[1] Unter thermischer Umlagerung oder Disproportionierung werden Alkalisalze aromatischer Carbonsäuren in symmetrische Dicarbonsäuren umgewandelt.[2]
Übersicht
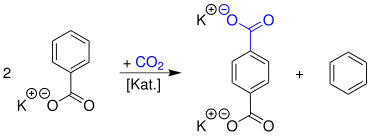
Ein Alkalisalz einer aromatischen Carbonsäure, hier Kaliumbenzoat, wird durch thermisch-katalytische Disproportionierung unter Zugabe von Kohlenstoffdioxid zur entsprechenden 1,4-Dicarbonsäure, hier Kaliumterephthalat, und dem entsprechenden Aromaten, hier Benzol, umgesetzt:[3]
Alternativ kann das Alkalisalz einer aromatische 1,2-Dicarbonsäure (hier Phthalsäure) durch eine thermisch-katalytische Umlagerung unter Zugabe von Kohlenstoffdioxid zu einem Alkalisalz einer aromatischen 1,4-Dicarbonsäure (Terephthalsäure) umgesetzt werden:[3]
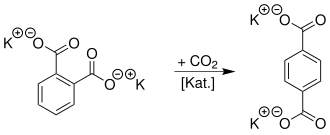
Als Katalysator wird jeweils Cadmium oder Zink verwendet.[4]
Reaktionsmechanismus
Die nachfolgende Darstellung zeigt einen Vorschlag für den Reaktionsmechanismus der Henkel-Reaktion am Beispiel der Disproportionierung von Kaliumbenzoat zu Kaliumterephthalat und Benzol:[3]
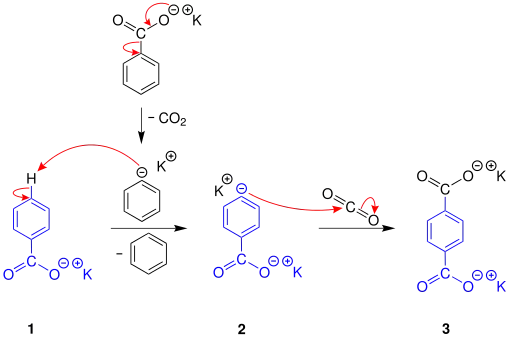
Zuerst wird Kaliumbenzoat (1) durch Abspaltung von Kohlenstoffdioxid in ein deprotoniertes Benzol umgesetzt. Dieses Anion deprotoniert nun ein zweites Molekül Kaliumbenzoat (1) in para-Position. Somit entsteht das in para-Position deprotonierte Kaliumbenzoat (2) und Benzol. Das Kaliumbenzoatanion (2) wird anschließend mit Kohlenstoffdioxid zu Kaliumterephthalat (3) umgesetzt.[3]
Ausbeute und weitere Nebenprodukte
Die Ausbeute steigt und fällt mit dem Druck, mit dem das Kohlenstoffdioxid zugeführt wird. Je höher der Druck ist, desto höher ist auch die Ausbeute. Außerdem hat die Wahl des Alkalimetalls einen Einfluss auf die Ausbeute. Wird Kalium, Rubidium und Cäsium verwendet, kann mit einer hohen Ausbeute gerechnet werden. Natrium und Lithium verschlechtern die Ausbeute hingegen.[5]
Bei der Henkel-Reaktion ist mit weiteren Nebenprodukten zu rechnen. Bei der Verwendung von Kaliumbenzoat können beispielsweise Diphenylmethan, Benzophenon und Triphenylmethan entstehen.[1]
Einzelnachweise
- Patent DE936036: Verfahren zur Herstellung von Terephthalsaeure. Angemeldet am 1. Dezember 1952, veröffentlicht am 1. Dezember 1955, Erfinder: B. Raecke.
- Reza Dabestani, Phillip F. Britt, A. C. Buchanan: Pyrolysis of Aromatic Carboxylic Acid Salts: Does Decarboxylation Play a Role in Cross-Linking Reactions? In: Energy & Fuels. Band 19, Nr. 2, März 2005, S. 365–373, doi:10.1021/ef0400722.
- Z. Wang (Hrsg.): Comprehensive Organic Name Reactions and Reagents, 3 Volume Set. John Wiley & Sons, Hoboken, New Jersey, 2009, ISBN 978-0-471-70450-8, S. 1380.
- Hiroaki Mori, Hiroaki Nakao: 2, 3, 6, 7-Naphthalenetetracarboxylic Dianhydride (NTCDA) as a Monomer for Polyimide. In: JFE technical report. Band 8, Nr. 6, 2005, S. 54–61 (PDF [abgerufen am 23. Dezember 2016]).
- Edward McNelis: Reactions of Aromatic Carboxylates. II. The Henkel Reaction. In: The Journal of Organic Chemistry. Band 30, Nr. 4, April 1965, S. 1209–1213, doi:10.1021/jo01015a060.