Habersche Regel
Die Habersche Regel ist eine in der Toxikologie verwendete mathematische Beziehung zwischen der Konzentration eines Giftstoffes und der Dauer der Verabreichung, beziehungsweise Exposition, dieses Giftes. Die Habersche Regel ist nach dem deutschen Chemiker Fritz Haber benannt, der diese Dosis-Dauer-Beziehung erstmals bei der Einwirkung von Giftgasen, unter anderem Phosgen, aufstellte.[1]
Konzentration × Dauer = konstant
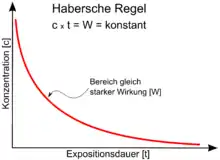
Die Habersche Regel besagt, dass ein konstantes Produkt aus Konzentration (c) und Dauer (t) einer konstanten biologischen Wirkung (k) entspricht:
Die biologische Wirkung kann eine Erkrankung (beispielsweise Krebs) oder der Tod des exponierten Lebewesens sein.
Mit anderen Worten besagt die Habersche Regel, dass identische Produkte von Konzentration und Dauer der Verabreichung dazu führen, dass die gleiche Wirkung eintritt. Das heißt, dass bei ständiger Zufuhr einer unterschwellig toxischen Dosis die Giftigkeit mit der Zeit ansteigt.
Im Diagramm (siehe Abbildung 1) mit linear skalierten Achsen ergibt sich die hyperbolische Kurvenform. In doppeltlogarithmischer Darstellung dagegen eine Gerade.
In der angelsächsischen Fachliteratur sind die Begriffe Haber's Law und Haber's Rule für die Habersche Regel gebräuchlich.
Beispiele
Beispiele für die Gültigkeit und Anwendbarkeit der Haberschen Regel sind das Tabakrauchen mit der Wirkung Lungenkrebs und die Einwirkung ionisierender Strahlungen auf Körpergewebe (Ultraviolettstrahlung → Hautkrebs).
Einschränkungen
Die Habersche Regel ist nur bei irreversiblen Wirkungen von Summationsgiften (auch Kumulationsgifte oder c·t-Gifte genannt) wie beispielsweise Blei, Quecksilber und allen krebserregenden Stoffen anwendbar.[2] Bei lebenswichtigen Spurenelementen, wie beispielsweise Selen oder Zink, versagt die Regel bei niedrigen Konzentrationen völlig. Bei Konzentrationsgiften, wie beispielsweise Kohlendioxid, ist die Habersche Regel ebenfalls nicht anwendbar.
Siehe auch
Einzelnachweise
- F. Haber: Zur Geschichte des Gaskrieges. In: Fünf Vorträge aus den Jahren 1920-1923 Julius Springer, 1924.
- H. Druckrey und K. Küpfmüller: Quantitative Analyse der Krebsentstehung. In: Zeitschrift für Naturforschung B. 3, 1948, S. 254–266 (PDF, freier Volltext).
Literatur
- J. Doull und K. K. Rozman: Using Haber’s Law to define the margin of exposure. In: Toxicology 149, 2000, S. 1–2. PMID 10963856
- D. W. Gaylor: The use of Haber’s Law in standard setting and risk assessment. In: Toxicology 149, 2000, S. 17–19. PMID 10963857
- K. K. Rozman: The role of time in toxicology or Haber’s c×t product. In: Toxicology 149, 2000, S. 35–42. PMID 10963859
- K. K. Rozman und J. J. Doull: The role of time as a quantifiable variable of toxicity and the experimental conditions when Haber's c × t product can be observed: implications for therapeutics. In: J Pharmacol Exp Ther 296, 2001, S. 663–668. PMID 11181890
- K. K. Rozman: Delayed acute toxicity of 1,2,3,4,6,7,8-tetracholordibenzo-p-dioxin (HpCDD) after oral administration obeys Haber's rule of inhalation toxicology. In: Toxicol Sci 49, 1999, S. 102–109. PMID 10367347
- S. A. Saghir u. a.: Validation of Haber's Rule (dose × time = constant) in rats and mice for monochloroacetic acid and 2,3,7,8-tetrachlorodibenzo-p-dioxin under conditions of kinetic steady state. In: Toxicology 215, 2005, S. 48–56. PMID 16076519
- M. V. Evans u. a.: A comparison of Haber's rule at different ages using a physiologically based pharmacokinetic (PBPK) model for chloroform in rats. In: Toxicology 176, 2002, S. 11–23. PMID 12062926
- C. I. Bliss: The relationship between exposure, time, concentration and toxicity in experiments on insecticides. In: Annals of the Entomological Society of America 33, 1940, S. 721–766.
- F. J. Miller u. a.: Haber's rule: a special case in a family of curves relating concentration and duration of exposure to a fixed level of response for a given endpoint. In: Toxicology 149, 2000, S. 22–34. PMID 10963858
- H. Witschi: Some Notes on the History of Haber's Law. (PDF; 90 kB) In: Toxicological Sciences 50, 1999, S. 164–168. PMID 10478852
- H. Witschi: Fritz Haber: December 9, 1868-January 29, 1934. In: Toxicology 149, 2000, S. 3–15. PMID 11023428
Weblinks
- Heberer, Einführung in die Toxikologie (PDF; 493 kB), MLU Halle-Wittenberg