Grosheintz-Fischer-Reissert-Aldehyd-Synthese
Die Grosheintz-Fischer-Reissert-Aldehyd-Synthese (auch Reissert-Aldehyd-Synthese genannt)[1][2] dient der Herstellung von Aldehyden ausgehend vom entsprechenden Carbonsäurechlorid. Die Reaktion ist eine Erweiterung der Reissert-Reaktion, in der ein Säurechlorid zur Reissert-Komponente umgesetzt wird. Als der deutsche Chemiker Arnold Reissert (1860–1945) die Reissert-Reaktion 1905 erstmals beschrieb, stellte er zusätzlich fest, dass die von ihm synthetisierte Reissert-Komponente in saurer Hydrolyse in den entsprechenden Aldehyd zerfällt.[3][4]
1941 bemerkten der in Deutschland geborene Chemiker Hermann O. L. Fischer (1888–1960) und der gebürtige Schweizer Chemiker Jean M. Grosheintz, dass die Reissert-Reaktion und die sich anschließende saure Hydrolyse, so wie sie von Reissert beschrieben wurde, nur für aromatische Komponenten gelingt.[5] Durch Änderung der Reaktionsbedingungen konnten sie nicht nur aromatische, sondern auch aliphatische Aldehyde aus den entsprechenden Säurechloriden synthetisieren.[5] Unter der Grosheintz-Fischer-Reissert-Aldehyd-Synthese wird daher eine Reissert-Reaktion mit anschließender saurer Hydrolyse verstanden, die ausgehend von aromatischen und aliphatischen Säurechloriden durchführbar ist und zu den jeweiligen Aldehyden führt.
Übersichtsreaktion
In der Grosheintz-Fischer-Reissert-Aldehyd-Synthese werden Säurechloride mit aromatischem oder aliphatischem Rest R zu den entsprechenden Aldehyden umgesetzt:[1]
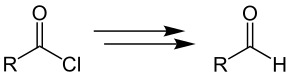
Etwas ausführlicher lässt sich die Übersichtsreaktion in zwei Teile gliedern. Im ersten Schritt erfolgt die von Grosheintz und Fischer modifizierte Reissert-Reaktion des Säurechlorids mit aliphatischem oder aromatischem Rest R zur Reissert-Komponente und im zweiten Schritt erfolgt die saure Hydrolyse der Reissert-Komponenten zum Aldehyd.[1]
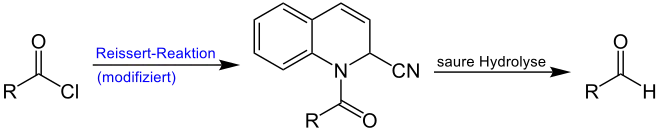
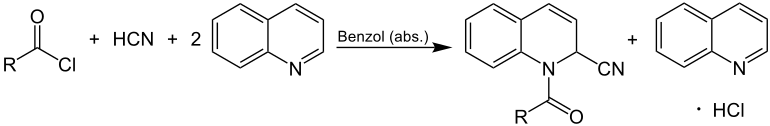
Auf die in blau markierte modifizierte Reissert-Reaktion wird an dieser Stelle näher eingegangen: Wie im Einleitungstext beschrieben, war es erst durch die Änderungen von Grosheintz und Fischer möglich, neben aromatischen Säurechloriden auch aliphatische Säurechloride zur gewünschten Reaktion zu bringen. Kernpunkt dieser Modifizierung war es, dass die Reissert-Reaktion in Benzol – einem nicht-wässrigen Lösungsmittel – durchgeführt werden muss. Außerdem wurden die stöchiometrischen Verhältnisse angepasst: Ein Äquivalent des Carbonsäurechlorids reagiert mit einem Äquivalent Cyanwasserstoff und zwei Äquivalenten Chinolin in absolutem Benzol:[5]
Reaktionsmechanismus
Für die Grosheintz-Fischer-Reissert-Aldehyd-Synthese wurden viele unterschiedliche Reaktionsmechanismen vorgeschlagen. Ein möglicher Mechanismus wird im Folgenden vorgestellt.[1][6]
Im ersten Teil des Reaktionsmechanismus erfolgt die modifizierte Reissert-Reaktion. Für diese Änderungen liegen allerdings keine expliziten Informationen vor, inwiefern sich der Mechanismus der Reissert-Reaktion ändert. Es scheint aber so, als ob sich der Mechanismus hinsichtlich der Bildung der Reissert-Komponente nicht ändern würde.[1] Auf die mechanistischen Details wird an dieser Stelle nicht weiter eingegangen, siehe dafür: Reissert-Reaktion.
Im zweiten Teil der Grosheintz-Fischer-Reissert-Aldehyd-Synthese erfolgt die saure Hydrolyse. Dabei kommt es zunächst zum intramolekularen Ringschluss der mesomeriestabilisierten Reissert-Komponenten (2), sodass (3) entsteht.[1][6] Danach bildet sich infolge einer Protonierung des Stickstoff-Atoms ein Imin (4) aus, aus dem sich durch Deprotonierung das Zwitterion (5) bildet. Nach zweifacher Protonierung entsteht die mesomeriestabilisierte Komponente (6), aus der unter der Addition von Wasser der gewünschte Aldehyd (7) hervorgeht.[1]

Atomökonomie
Die Atomökonomie der Grosheintz-Fischer-Reissert-Aldehyd-Synthese ist eher als schlecht einzustufen. Im Rahmen dieser Namensreaktion werden nämlich große Moleküle (wie Chinolin) benötigt, die in substituierter Form als nicht gewünschtes Nebenprodukt anfallen.
Anwendung
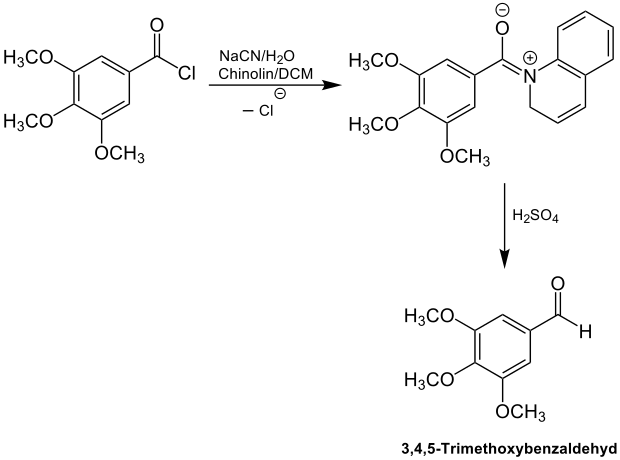
Die Grosheintz-Fischer-Reissert-Aldehyd-Synthese wird zur Synthese von Aldehyden genutzt. In diesem Bereich wird auch die Rosenmund-Reaktion angewendet. Allerdings soll die hier vorgestellte Aldehyd-Synthese nach Grosheintz, Fischer und Reissert besser geeignet sein als die Rosenmund-Reduktion, weil es bei letzterer zu Katalysatorvergiftungen kommen kann.[1][7] Ein Beispiel hierfür ist die Synthese von 3,4,5-Trimethoxybenzaldehyd aus 3,4,5-Trimethoxybenzoylchlorid:[7]
Einzelnachweise
- Z. Wang: Comprehensive Organic Name Reactions and Reagents. Volume 3, John Wiley & Sons, Hoboken 2009, ISBN 978-0-471-70450-8, S. 1284–1287.
- B. P. Mundy, M. G. Ellerd, F. G. Favaloro, Jr.: Name Reactions and Reagents in Organic Synthesis. 2. Auflage. Wiley-Interscience, Hoboken 2005, ISBN 0-471-22854-0, S. 16.
- A. Reissert: Über die Einführung der Benzoylgruppe in tertiäre cyclische Basen. In: Berichte der deutschen chemischen Gesellschaft. Band 38, Nr. 2, 1905, S. 1603–1614, doi:10.1002/cber.19050380260.
- A. Reissert: Über die Einführung der Benzoylgruppe in tertiäre cyclische Basen. (II. Mitteilung). In: Berichte der deutschen chemischen Gesellschaft. Band 38, Nr. 3, 1905, S. 3415–3435, doi:10.1002/cber.190503803170.
- J. M. Grosheintz, H. O. L. Fischer: Preparation of 1-Acyl-1,2-dihydroquinaldonitriles and their Hydrolysis to Aldehydes. In: Journal of the American Chemical Society. Band 63, Nr. 7, 1941, S. 2021–2022, doi:10.1021/ja01852a066.
- R. L. Cobb, W. E. McEwen: Mechanism of the Acid-catalyzed Hydrolysis of Reissert Compounds. In: Journal of the American Chemical Society. Band 77, Nr. 19, 1955, S. 5042–5048, doi:10.1021/ja01624a031.
- A. Schwartz: Efficient Synthesis of 3,4,5-Trimethoxybenzaldehyde via Reissert Aldehyde Synthesis. In: The Journal of Organic Chemistry. Band 47, Nr. 11, 1982, S. 2213–2214, doi:10.1021/jo00132a053.