Gemtuzumab-Ozogamicin
Gemtuzumab-Ozogamicin (auch Gemtuzumab ozogamicin geschrieben; Handelsname Mylotarg; Hersteller Wyeth) ist ein Immunkonjugat, das aus einem humanisierten, mit einem bakteriellen Toxin verbundenen, monoklonalen Antikörper besteht. Der monoklonale Antikörper ist gegen das CD33-Antigen gerichtet und wird im Rahmen einer Krebsimmuntherapie zur Behandlung der akuten myeloischen Leukämie (AML) eingesetzt. Seit April 2018 ist er zur Behandlung der CD33 positiven AML in Kombination mit Chemotherapie zugelassen.
| Gemtuzumab-Ozogamicin | ||
|---|---|---|
| ||
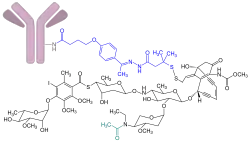
| Durchschnittlich 2-3 Moleküle des N-acetylierten (türkis) Bakterientoxins γ-Calicheamicin (schwarz) sind über einen spaltbaren Linker (blau) an den monoklonalen anti-CD33-Antikörper hP67.6 (Gemtuzumab, rosa) gebunden | ||
| Masse/Länge Primärstruktur | 151 bis 153 kDa | |
| Bezeichner | ||
| Externe IDs | ||
| Arzneistoffangaben | ||
| ATC-Code | L01XC05 | |
| DrugBank | DB00056 | |
| Wirkstoffklasse | Monoklonaler Antikörper, Zytostatikum | |
Klinische Angaben
Anwendungsgebiete
Gemtuzumab ozogamicin wird zur Erstlinientherapie der akuten myeloischen Leukämie, bei Nachweis der CD33-Positivität, eingesetzt. Dabei erfolgt eine Kombination als GO mit einer entsprechenden Chemotherapie – zumeist nach dem 7 + 3-Schema. In den USA ist die Zulassung auf Patienten beschränkt, die älter als 60 Jahre sind und für eine konventionelle Chemotherapie nicht in Frage kommen. Das Mittel wird durch Infusion verabreicht. Gemtuzumab ozogamicin darf bei bekannter Überempfindlichkeit gegen einen der Bestandteile nicht angewendet werden.
Das Arzneimittel ist bei Schwangerschaften kontraindiziert; eine schädliche Wirkung auf den Fötus ist anzunehmen.
Unerwünschte Wirkungen
Die häufigsten Nebenwirkungen sind Schüttelfrost, Fieber, Übelkeit, Erbrechen und Kopfschmerzen. Oft werden vor der eigentlichen Behandlung Arzneimittel zur Vermeidung einer Infusionsreaktion gegeben. Die Behandlung mit Gemtuzumab ozogamicin kann die normale Blutbildung negativ beeinflussen und zu langanhaltender Myelosuppression führen. Viele Patienten erleiden eine Neutropenie und/oder eine Thrombozytopenie. Auch Lebertoxizität und ein sinusoidales Obstruktionssyndrom wurden beobachtet.
Pharmakologische Eigenschaften
Der Antikörper Gemtuzumab ist gegen das CD33-Antigen gerichtet, ein Sialinsäure bindendes Lektin aus der SIGLEC-Familie, das bei zirka 80 % der AML-Patienten auf der Zelloberfläche der leukämischen Blasten nachgewiesen werden kann. Wenn Gemtuzumab ozogamicin an CD33 auf der Zelloberfläche der Blasten bindet, wird ein Komplex gebildet, der in die Zelle aufgenommen wird. Dort wird das Toxin freigesetzt und die Giftwirkung tritt ein. Die CD33 exprimierenden Zellen sollen so selektiv abgetötet werden.
Chemische Informationen
Der Wirkstoff ist ein Konjugat aus dem humanisierten, rekombinant hergestellten monoklonalen Antikörper Gemtuzumab vom Typ IgG4 mit einem N-Acetyl-Derivat des Toxins γ-Calicheamicin aus dem Bakterium Micromonospora echinospora. Das Toxin wird über einen bifunktionalen Linker kovalent an den Antikörper gebunden. Im Schnitt kommen auf jedes Antikörpermolekül circa zwei bis drei Toxinmoleküle.
Entwicklung und Zulassung
Mylotarg wurde im Mai 2000 in den USA von der Food and Drug Administration (FDA) zur Behandlung der akuten myeloischen Leukämie zugelassen. Es war die erste Zulassung eines Antikörper-Toxin-Konjugates weltweit. Darüber hinaus erhielt das Arzneimittel sowohl in den USA als auch in der Europäischen Union den Status eines Orphan-Arzneimittels.
Ein Zulassungsantrag für die Europäische Union wurde 2008 abgewiesen. Im Herbst 2007 hatte der Ausschuss für Humanarzneimittel der Europäischen Arzneimittelagentur (EMA) nach einer ungewöhnlich langen Bearbeitungszeit eine negative Beurteilung für Mylotarg abgegeben, die in einer nochmaligen Überprüfung Anfang 2008 bestätigt wurde. Auf der Grundlage dieser wissenschaftlichen Beurteilung lehnte die Europäische Kommission die Zulassung im April 2008 ab. Zur Ablehnung trugen in erster Linie die vorgelegten Daten zum Wirksamkeitsnachweis bei. Die EMA war der Ansicht, dass mit dem gegebenen Studiendesign, der heterogenen Patientenpopulation und der geringen Zahl der Patienten mit vollständiger Remission die Wirksamkeit in der angegebenen Indikation nicht hinreichend nachgewiesen wurde; angesichts der teils schweren Nebenwirkungen sei damit auch das Nutzen-Risiko-Verhältnis ungünstig.[1]
Auch in den USA nahm Pfizer Mylotarg 2010 auf Anraten der FDA vom Markt. In weitere Studien hatte sich gezeigt, dass die Patienten unter Gemtuzumab-Ozogamicin plus herkömmlicher Chemotherapie keinen Nutzen gegenüber der Standardtherapie hatten, zudem waren vermehrt schwere Nebenwirkungen, einschließlich Todesfälle, beobachtet worden.[2]
Im September 2017 wurde das Antikörper-Toxin-Konjugat seitens der FDA erneut zur Behandlung der AML zugelassen;[3] im April 2018 folgte auch die Zulassung in der EU.[4] Die Zulassung beruht auf einem umfassenden Studienprogramm, inklusive der pivotalen Phase-III-Studie ALFA-0701.[5]
Weblinks
- Mylotarg - gemtuzumab ozogamicin auf der Website der Europäischen Arzneimittelagentur
- Label der FDA zu Mylotarg (englisch, PDF; 351 kB)
Quellen
- Mylotarg - gemtuzumab ozogamicin (Europäischer öffentlicher Beurteilungsbericht zur Ablehnung von Mylotarg), 24. Januar 2008.
- USA: Revival für Krebsmedikament Mylotarg, Pharmazeutische Zeitung, 4. September 2017.
- FDA approves Mylotarg for treatment of acute myeloid leukemia, PM FDA vom 1. September 2017, abgerufen am 7. September 2017
- European Medicines Agency - Human medicines - Mylotarg. Abgerufen am 2. September 2019 (englisch).
- Assessment Report Mylotarg, Committee for Medicinal Products for Human Use (CHMP), 22. Februar 2018.