Gamma-Sekretase
Die Gamma-Sekretase ist ein aus mehreren Untereinheiten bestehender Proteinkomplex und ein integrales (in die Lipidschicht der Zellmembran eingelagertes) Membranprotein. Die Protease-Untereinheit des Komplexes schneidet Transmembranproteine innerhalb der Transmembrandomäne. Das bekannteste Substrat der Gamma-Sekretase ist das Amyloid-Precursor-Protein (APP), ein großes integrales Membranprotein. Die Gamma-Sekretase prozessiert auch das Protein Notch.
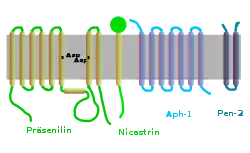
Der Proteinkomplex besteht aus vier Untereinheiten, deren Anwesenheit für die Funktion ausreicht: ein Präsenilin-1- oder -2-Homodimer, Nicastrin, Stabilisationfaktor APH-1 und Präsenilin-Enhancer 2 (PEN-2). Da APH-1 in drei Isoformen auftritt (APH-1A-Long, APH-1A-Short, APH-1B), sind sechs verschiedene Isoformen der gamma-Sekretase möglich. Neuere Ergebnisse, nach denen ein fünftes Protein, CD147, als nicht essentieller Regulator die Aktivität des Komplexes erniedrigt, wurden inzwischen widerlegt.[2][3][4]
Zusammenbau des Komplexes
Während der Entstehung des Gamma-Sekretase-Komplexes werden die Untereinheiten in hohem Maße durch limitierte Proteolyse modifiziert. Ein essentieller Schritt zur Aktivierung des Komplexes ist die autokatalytische Spaltung von Präsenilin in ein C-terminales und ein N-terminales Fragment. Die Rolle des Nicastrins besteht in der Stabilisierung des Komplexes und der Steuerung von dessen intrazellulären Transports.
PEN-2 verbindet sich mit dem Komplex, indem es an die Transmembrandomäne des Präsenilins bindet. Es stabilisiert den Komplex nach der Spaltung des Präsenilins. Weitere Rollen des PEN-2 sind noch unbekannt. APH-1 bindet durch ein konserviertes α-Helix-Bindungsmotiv an den Komplex und ist bei der Einleitung der Bildung des Komplexes durch noch unreife Bestandteile beteiligt.
Der Gamma-Sekretasekomplex bildet sich durch Proteolyse im endoplasmatischen Retikulum (ER). Er wird dann in das späte ER transportiert, wo er seine Substrate schneidet. Er kommt auch in Mitochondrien vor, wo er vermutlich eine unterstützende Rolle bei der Apoptose spielt.[5]
Nicastrin
Nicastrin (Abk. NCT) wird für die Reifung und den Transport der anderen Proteine des Komplexes benötigt, ist aber selbst nicht katalytisch aktiv.
APH-1
APH-1 (anterior pharynx-defective 1) ist ein Protein, das zuerst im Notch-Stoffwechselweg in Caenorhabditis elegans als Regulator der Lokalisierung von Nicastrin an der Zelloberfläche gefunden wurde. Später wurden APH-1-Homologe in anderen Organismen – so auch im Menschen – identifiziert, wo diese Teil des Gamma-Sekretasekomplexes sind. APH-1 und PEN-2 werden als Regulatoren des Reifungsprozesses des katalytisch aktiven Präsenilins angesehen.
APH-1 enthält das konservierte α-Helix-Bindungsmotiv Glycin-X-X-X-Glycin (kurz: GXXXG). Dieses ist sowohl bei der Bildung als auch bei der Reifung des Gamma-Sekretase-Komplexes entscheidend.
PEN-2
PEN-2 (kurz für presenilin enhancer 2, engl. „Präsenilin-Verstärker 2“) ist ein integrales Membranprotein aus 101 Aminosäuren. Wahrscheinlich befinden sich sowohl der N-Terminus als auch der C-Terminus nach der Translation zunächst im Lumen des endoplasmatischen Retikulums und später außerhalb der Zelle. Sowohl das konservierte Sequenzmotiv Asp-Tyr-Leu-Ser-Phe am C-Terminus wie auch die Gesamtlänge des C-Terminus sind für die Bildung des aktiven Gamma-Sekretasekomplexes notwendig.
Weiterführende Literatur
- Kimberly WT, LaVoie MJ, Ostaszewski BL, Ye W, Wolfe MS, Selkoe DJ: Gamma-secretase is a membrane protein complex comprised of presenilin, nicastrin, Aph-1, and Pen-2. In: Proc. Natl. Acad. Sci. U.S.A.. 100, Nr. 11, Mai 2003, S. 6382–7. doi:10.1073/pnas.1037392100. PMID 12740439. PMC 164455 (freier Volltext).
- Fraering PC, Ye W, Strub JM, et al.: Purification and characterization of the human gamma-secretase complex. In: Biochemistry. 43, Nr. 30, August 2004, S. 9774–89. doi:10.1021/bi0494976. PMID 15274632.
- Culvenor JG, Ilaya NT, Ryan MT, et al.: Characterization of presenilin complexes from mouse and human brain using Blue Native gel electrophoresis reveals high expression in embryonic brain and minimal change in complex mobility with pathogenic presenilin mutations. In: Eur. J. Biochem.. 271, Nr. 2, Januar 2004, S. 375–85. PMID 14717705.
Einzelnachweise
- Lazarov VK, Fraering PC, Ye W, Wolfe MS, Selkoe DJ, Li H: Electron microscopic structure of purified, active gamma-secretase reveals an aqueous intramembrane chamber and two pores. In: Proc. Natl. Acad. Sci. U.S.A.. 103, Nr. 18, Mai 2006, S. 6889–94. doi:10.1073/pnas.0602321103. PMID 16636269. PMC 1458989 (freier Volltext).
- Sato T, Diehl TS, Narayanan S, et al.: Active gamma-secretase complexes contain only one of each component. In: J. Biol. Chem.. 282, Nr. 47, November 2007, S. 33985–93. doi:10.1074/jbc.M705248200. PMID 17911105.
- Shirotani K, Edbauer D, Prokop S, Haass C, Steiner H: Identification of distinct gamma-secretase complexes with different APH-1 variants. In: J. Biol. Chem.. 279, Nr. 40, Oktober 2004, S. 41340–5. doi:10.1074/jbc.M405768200. PMID 15286082.
- Vetrivel KS, Zhang X, Meckler X, et al.: Evidence that CD147 modulation of beta-amyloid (Abeta) levels is mediated by extracellular degradation of secreted Abeta. In: J. Biol. Chem.. 283, Nr. 28, Juli 2008, S. 19489–98. doi:10.1074/jbc.M801037200. PMID 18456655. PMC 2443668 (freier Volltext).
- C. Kaether, C. Haass, H. Steiner: Assembly, trafficking and function of gamma-secretase. In: Neuro-degenerative diseases. Bd. 3, Nr. 4–5, 2006, ISSN 1660-2854 S. 275–283