Fukuyama-Aminsynthese
Die Fukuyama-Aminsynthese, auch Fukuyama-Mitsunobu-Reaktion genannt, ist eine Namensreaktion der organischen Chemie. Tohru Fukuyama und seine Mitarbeiter haben diese Synthese 1995 entdeckt. Es handelt sich um eine zweischrittige Synthese von sekundären Aminen aus primären Aminen.[1][2] Durch die Verwendung der Reagenzien Triphenylphosphan und Diethylazodicarboxylat (DEAD) oder Diisopropylazodicarboxylat (DIAD) weist sie eine gewisse Ähnlichkeit zur Mitsunobu-Reaktion auf.[1][2]
Übersichtsreaktion
Bei der Fukuyama-Aminsynthese handelt es sich um eine Reaktion mit Schutzgruppen. Dabei wird das primäre Amin üblicherweise durch Reaktion mit o-Nitrobenzolsulfonsäurechlorid als Sulfonamid geschützt.[3] Zwecks Übersichtlichkeit wird die Schutzgruppe im Folgenden nur verkürzt skizziert:
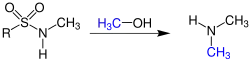
Die Reaktion benötigt ein neutrales Milieu. Außerdem muss ein Alkohol zugegeben werden. Dieser und das primäre Edukt ergeben dann das sekundäre Produkt. Katalysiert wird die Reaktion durch die Anwesenheit von Triphenylphosphan und Diethylazodicarboxylat (DEAD) oder Diisopropylazodicarboxylat (DIAD), wobei die Verwendung von DIAD die Reaktion um einiges effizienter macht.[4] Um das Produkt wieder von der Schutzgruppe zu lösen wird ein Gemisch aus Thiophenol und Kaliumcarbonat hinzugegeben.[2]
Mechanismus
Folgender Reaktionsmechanismus wurde vorgeschlagen:[1]

Zunächst wird die Schutzgruppe gebildet. Dazu reagiert das o-Nitrobenzolsulfonchlorid (2) mit dem primären Amin (1). Nach einigen Umlagerungen wird dann Chlorwasserstoff abgespalten. Jetzt kommt ein Gemisch aus Triphenylphosphan und DEAD zum Einsatz und deprotoniert das Stickstoff-Atom der Schutzgruppe 3. Es bildet sich ein Zwischenprodukt 4. Im nächsten Schritt reagiert das protonierte Triphenylposphan-DEAD mit dem zugegebenen Alkohol 5 zu einem weiteren Zwischenprodukt 6. Die beiden Zwischenprodukte 4 und 6 reagieren nun miteinander, sodass das Stickstoff-Atom nun zwei Alkylreste aufweist 7. Nun wird das oben erwähnte Gemisch aus Thiophenol und Kaliumcarbonat hinzugegeben. Das Thiophenolat bindet sich an das Schwefel-Atom aus der Schutzgruppe. Das Stickstoff-Atom deprotoniert das Hydrogencarbonat und spaltet sich so von der Schutzgruppe ab, wobei das sekundäre Amin (8) entsteht.[2]
Anwendung
Die Fukuyama-Reaktion wird zur Synthese von sekundären und tertiären Aminen verwendet. Außerdem können auch Polyamide hergestellt werden. Besonders gut geeignet ist sie für Festphasensynthesen.[1] Besonders gut läuft die Synthese von N-Methyl-aminosäuren aus aliphatischen und aromatischen Aminosäuren, wie zum Beispiel Alanin, Valin oder Tryptophan ab. Hierbei werden sehr hohe Ausbeuten sowie eine hohe Reinheit erzielt.[5]
Kritik
Die Fukuyama-Synthese ist ein reines Laborverfahren. Trotz hoher Ausbeuten ist die Atomökonomie der Fukuyama-Synthese, wegen der Bildung stöchiometrischer Mengen mehrerer Abfallstoffe, so schlecht, dass niemand eine technische Synthese für sekundäre Amine basierend auf dieser Reaktion realisiert.[5][2]
Einzelnachweise
- Zerong Wang: Comprehensive Organic Name Reactions and Reagents. John Wiley & Sons, New Jersey 2009, ISBN 978-0-471-70450-8, S. 1159–1163.
- Tohru Fukuyama, Chung-Kuang Jow, Mul Cheung: 2- and 4-Nitrobenzenesulfonamides: Exceptionally Versatile Means for Preparation of Secondary Amines and Protection of Amines. In: Tetrahedron Letters. Band 36, 1995, S. 6373–6374, doi:10.1021/ol100914b.
- Xiaodong Lin, Hilary Dorr, John M. Nuss: Utilization of Fukuyama’s sulfonamide protecting group for the synthesis of N-substituted α-amino acids and derivatives. In: Tetrahedron Letters. Band 41, Nr. 18, 29. April 2000, S. 3309–3313, doi:10.1016/S0040-4039(00)00424-X.
- Yosup Rew, Murray Goodman: Solid-Phase Synthesis of Amine-Bridged Cyclic Enkephalin Analogues via On-Resin Cyclization Utilizing the Fukuyama−Mitsunobu Reaction. In: The Journal of Organic Chemistry. Band 67, Nr. 25, Dezember 2002, S. 8820–8826, doi:10.1021/jo020447l.
- Lihu Yang, Kuenley Chiu: Solid phase synthesis of Fmoc N-methyl amino acids: Application of the Fukuyama amine synthesis. In: Tetrahedron Letters. Band 38, Nr. 42, 20. Oktober 1997, S. 7307–7310, doi:10.1016/S0040-4039(97)01774-7.