Fenestrane
Fenestrane (von lateinisch Fenestra und Alkane)[1] sind chemische Verbindungen aus der Gruppe der polycyclischen aliphatischen Kohlenwasserstoffe.[2] Sie bestehen aus vier kondensierten Ringen mit einem zentralen quartären Kohlenstoffatom, das Bestandteil aller Ringe des Moleküls ist und dessen vier Bindungen durch die Ringspannung deformiert sind. Die tetraedrische Anordnung wird eingeebnet und liegt zwischen einer tetraedrischen und planaren Konfiguration.[3] Das Grundgerüst der Fenestrane kann auch als eine doppelt überbrückte Spiroverbindung beschrieben werden.[4]
Die namensgebende Verbindung für die Stoffgruppe ist das [4.4.4.4]Fenestran (IUPAC-Bezeichnung: Tetracyclo[3.3.1.03,9.07,9]nonan), mitunter auch als Windowpan bezeichnet.[1][5][6] Das kleinste mögliche Fenestran ist das [3.3.3.3]Fenestran, auch Pyramidan genannt.[4] Für das [5.5.5.5]Fenestran findet man in der Literatur auch die Bezeichnung Stauran (altgriechisch σταυρός stauros, deutsch ‚Kreuz‘).[6]
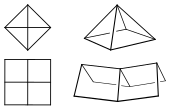
Berechnete Strukturen von [3.3.3.3]Fenestran (oben)
und [4.4.4.4]Fenestran (unten)
Nomenklatur
Da die Bezeichnung der Fenestrane nach der IUPAC-Nomenklatur relativ komplex ist, wurde für die Verbindungen mit diesem Grundgerüst eine Nomenklatur unter Verwendung des Präfixes [m.n.p.q] für die Definition der Größe der vier Ringe vorgeschlagen.[7] Mit dieser Bezeichnungsweise können auch tricyclische Strukturen, also einfachüberbrückte Spiroalkane, als [m.n.p]Fenestrane bezeichnet werden, für die man in der Literatur auch die Bezeichnung „zerbrochene Fenster“ findet.

Die Nummerierung des Fenestrangerüsts beginnt am Brückenkopf-Kohlenstoffatom C1 mit der höchsten Priorität, folgt von dort dem äußeren Rahmen und endet am zentralen Kohlenstoffatom. Die C1-Position definiert auch den Ausgangspunkt für die Zuordnung der Ringgrößen gemäß der [m.n.p.q]-Definition, die den Ringen im Uhrzeigersinn folgt. Falls die Zuordnung des Brückenkopfatoms mit der höchsten Priorität nicht eindeutig ist, beginnt die Nummerierung mit dem kleinsten Ring.[4]

Beispiele: [5.5.5.5]Fenestran und [4.5.5.5]Fenestran
Fenestrane mit unterschiedlichen Substituenten an den vier Brückenkopfatomen enthalten fünf Stereozentren. Die Stereochemie des Grundgerüsts kann mit der cis/trans-Beziehung zwischen den Bindungen beschrieben werden. Bei einem [5.5.5.5]Fenestran wird zunächst die cis/trans-Beziehung der H1-C1-C13-C7-Bindungen beschrieben, gefolgt von den Dreiergruppierungen H4-C4-C13-C10, H7-C7-C13-C1 und zuletzt H10-C10-C13-C4.[8][4]
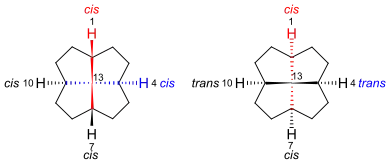
Synthese
1982 veröffentlichten William G. Dauben et al. die Darstellung des unsubstituierten [4.5.5.5]Fenestrans durch eine intramolekulare Photocyclisierung eines bicyclischen Enons mit einem Olefin. Ausgehend von Methyl-2-oxocyclopentancarboxylat[9] 1 erhält man über mehrere Stufen das mit einer Butenylgruppe substituierte bicyclische Enon 2, das photochemisch in das [4.5.5.5]Fenestron 3 umgewandelt wird. Aus dieser Zwischenstufe erhält man durch Umsetzung mit Hydrazin und KOH in einer Wolff-Kishner-Reduktion [4.5.5.5]Fenestran 4[10]
Fenestrane.svg.png.webp)
Die erste Synthese des all-cis-[5.5.5.5]Fenestrans wurde 1984 von Reinhart Keese et al. publiziert.[11][12] Mit Cycloocta-1,5-dien 1 als Ausgangsverbindung erhält man über eine mehrstufige Reaktionsfolge ein Lacton 2, das mit Wasserstoff unter Palladium-Kohle-Katalyse in einer reduktiven Decarboxylierung zu dem Fenestran 3 umgesetzt werden kann.[2]
Fenestrane_from_1%252C5-Cyclooctadiene.svg.png.webp)
Struktur
Die Möglichkeit einer planaren Deformation des zentralen tetrakoordinierten Kohlenstoffatoms bei Verbindungen mit einer Fenestranstruktur, wurde bereits 1970 von Roald Hoffmann diskutiert.[13] Die Auswirkungen verschiedener Modifikationen im Fenestrangerüst auf die Abweichung der Bindungswinkel des zentralen Kohlenstoffatoms vom Tetraederwinkel wurde mit verschiedenen Methoden, beispielsweise Ab-initio-Methoden der Quantenchemie, Dichtefunktionaltheorie, semi-empirische Methoden oder Molekülmechanikansätze, berechnet. Demnach haben die beiden gegenüberliegenden Winkel α und β im all-cis-[5.5.5.5]Fenestran einen Wert von 113,8°. Durch weitere Doppelbindungen in Brückenkopfpositionen werden diese Winkel bis zu einem Wert von 137° bei dem [5.5.5.5]Fenestran-1,4,7,10-tetraen aufgeweitet.[4][8]

Die Verkleinerung von Ringen im Fenestrangerüst, die Einführung von anspruchsvollen Substituenten in den Brückenkopfpositionen, sowie der Übergang von cis- zu trans-Isomeren führt zu einer weiteren Aufweitung der Bindungswinkel α und β. Das 1,6-Dimethyl-[4.5.5.5]fenestr-6-en besitzt mit 140° und 132° die bislang größten berechneten Winkel.[4][6]

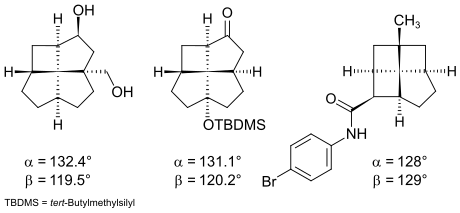
Die durch eine Röntgenstrukturanalyse gemessenen Winkel bei kristallinen Fenestranen stimmen im Allgemeinen gut mit den berechneten Winkeln überein. Die größten gemessenen Winkel wurden bei folgenden [4.5.5.5]- und [4.4.45]Fenestranen gefunden:[4]
Naturstoffe
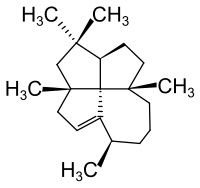
Der erste und bislang einzige isolierte Naturstoff aus der Stoffgruppe der Fenestrane ist das Laurenen, ein Diterpen aus Dacrydium cupressinum mit einem [5.5.5.7]Fenestren-Gerüst.[4]
Naturstoffe mit einem [m.n.p]Fenestrangerüst sind weiter verbreitet, beispielsweise sind dies Sesquiterpene mit einem Tricyclo[6.3.0.01.5]undecan-Gerüst. Ebenso findet man in der Natur Verbindungen mit einem Heterofenestran-Gerüst[4]
Einzelnachweise
- Vlasios Georgian, Martin Saltzman: Syntheses directed toward saturated “flat” carbon. In: Tetrahedron Letters. Band 13, Nr. 42, 1972, S. 4315–4317, doi:10.1016/S0040-4039(01)94304-7.
- Karsten Krohn: Fenestrane - Blick auf strukturelle Pathologien. In: Nachrichten aus Chemie, Technik und Laboratorium. Band 35, Nr. 3, 1987, S. 264–266, doi:10.1002/nadc.19870350307.
- Armin Pfenninger, Alex Roesle, Reinhart Keese: Planarisierung von tetrakoordiniertem Kohlenstoffatom. Synthese des überbrückten all-cis-[5.5.5.5]Fenestrans 13-Oxapentacyclo[5.5.2.11.7.04,15.010,15] pentadecan-14-on. In: Helvetica Chimica Acta. Band 68, Nr. 2, 1985, S. 493–507, doi:10.1002/hlca.19850680223.
- Aicha Boudhar, Mélanie Charpenay, Gaëlle Blond, Jean Suffert: Fenestrane in der Synthese: einzigartige und inspirierende Grundgerüste. In: Angewandte Chemie. Band 125, Nr. 49, 2013, S. 13020–13032, doi:10.1002/ange.201304555.
- Alex Nickon, Ernest F. Silversmith: Organic Chemistry: The Name Game. Modern Coined Terms and Their Origins. Pergamon Press, New York 1987, ISBN 0-08-034481-X, S. 55 (eingeschränkte Vorschau in der Google-Buchsuche).
- Bhaskar Rao. Venepalli, William C. Agosta: Fenestranes and the flattening of tetrahedral carbon. In: Chemical Reviews. Band 87, Nr. 2, 1987, S. 399–410, doi:10.1021/cr00078a007.
- Joel F. Liebman, Arthur Greenberg: A survey of strained organic molecules. In: Chemical Reviews. Band 76, Nr. 3, 1976, S. 311–365, doi:10.1021/cr60301a002.
- Reinhart Keese: Carbon Flatland: Planar Tetracoordinate Carbon and Fenestranes. In: Chemical Reviews. Band 106, Nr. 12, 2006, ISSN 0009-2665, S. 4787–4808, doi:10.1021/cr050545h.
- Externe Identifikatoren von bzw. Datenbank-Links zu Methyl-2-oxocyclopentancarboxylat: CAS-Nummer: 10472-24-9, EG-Nummer: 233-962-7, ECHA-InfoCard: 100.030.862, PubChem: 66328, ChemSpider: 59706, Wikidata: Q72489748.
- William G. Dauben, Daniel M. Walker: Synthesis of (4.5.5.5]fenestrane and a [4.4.5.5]fenestrane derivative. In: Tetrahedron Letters. Band 23, Nr. 7, 1982, S. 711–714, doi:10.1016/S0040-4039(00)86928-2.
- Marcel Luyten, Reinhart Keese: all-cis-[5.5.5.5]Fenestran. In: Angewandte Chemie. Band 96, Nr. 5, 1984, S. 358–359, doi:10.1002/ange.19840960515.
- Marcel Luyten, Reinhart Keese: Planarisation of Tetracoordinate Carbon Atom. A Further Route ot (all-cis)-[5.5.5.5]Fenestrane. In: Helvetica Chimica Acta. Band 67, Nr. 8, 1984, S. 2242–2245, doi:10.1002/hlca.19840670829.
- Roald Hoffmann, Roger W. Alder, Charles F. Wilcox: Planar tetracoordinate carbon. In: Journal of the American Chemical Society. Band 92, Nr. 16, 1970, S. 4992–4993, doi:10.1021/ja00719a044.