Einhorn-Brunner-Reaktion
Die Einhorn-Brunner-Reaktion ist eine Namensreaktion der organischen Chemie. Sie wurde nach dem deutschen Chemiker Alfred Einhorn benannt, der sie im Jahre 1905 veröffentlichte. 1914 wurde die Reaktion von Karl Brunner (1855–1935) erweitert und daher als Einhorn-Brunner-Reaktion bekannt.[1] Mit Hilfe der Reaktion lassen sich 1,2,4-Triazole aus Hydrazinen und Diacylaminen synthetisieren.[2][3][4][5][6]
Übersicht
Hydrazine reagieren in der Gegenwart einer Säure mit Diacylaminen zu 1,2,4-Triazolen:
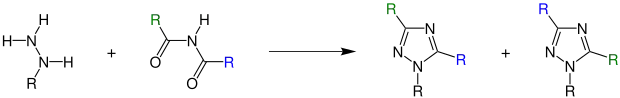 R = organischer Rest, die Reste können gleich aber auch verschieden sein[1]
R = organischer Rest, die Reste können gleich aber auch verschieden sein[1]
In dem Fall, dass die organischen Reste am Diacylamin unterschiedlich sind, entsteht ein Gemisch isomerer Triazole. Der Rest am Imid, der von der stärkeren Säure abstammt, wird hauptsächlich in der Position 3 des Triazols angetroffen. Bei zwei gleichen Acylgruppen am Amin entsteht entsprechend nur ein Produkt.[1]
Mechanismus
Der Einfachheit halber wird im hier vorgestellten Mechanismus nur die Reaktion zu einem der entstehenden Triazolisomere dargestellt.
 Mechanismus der Einhorn-Brunner-Reaktion
Mechanismus der Einhorn-Brunner-Reaktion
Zunächst wir das elektronenreichere Stickstoffatom in dem Hydrazin-Derivat 1 protoniert, wobei das Kation 2 entsteht. 2 überträgt ein Proton auf das Sauerstoffatom der Carbonylgruppe des Diacylamins. Außerdem greift die Aminogruppe die elektrophilere Carbonylgruppe an, was dafür sorgt, dass ein Ammonium-Intermediat 3 entsteht.[1] Durch Abspaltung von Wasser entsteht aus 3 das Iminiumion 4. Es folgt eine 1,5-Protonenverschiebung vom Stickstoffatom zur Carbonylgruppe unter Bildung des mesomeriestabilisierten Intermediates 5 (hier ist nur eine mesomere Grenzstruktur gezeichnet). Das Kohlenstoffatom der protonierten Carbonylgruppe in 5 wird nun intramolekular vom Stickstoffatom angegriffen, was zur Schließung eines Fünfrings unter Entstehung von 6 führt. Unter Abspaltung von Wasser und eines Proton bildet sich über die Zwischenstufen 7 und 8 der Aromat 9, ein 1,2,4-Triazol.
Siehe auch
Einzelnachweise
- Z. Wang (Hrsg.): Comprehensive Organic Name Reactions and Reagents. 3 Volume Set. John Wiley & Sons, Hoboken, NJ 2009, ISBN 978-0-471-70450-8, S. 971–972.
- Karl Brunner: Eine neue Darstellungsweise von sekundären Säureamiden. In: Berichte der deutschen chemischen Gesellschaft. Band 47, Nr. 3, Juli 1914, S. 2671–2680, doi:10.1002/cber.19140470351.
- Alfred Einhorn, Eduard Bischkopff, Bruno Szelinski, Gustav Schupp, Eduard Spröngerts, Carl Ladisch, Theodor Mauermayer: Ueber die N-Methylolverbindungen der Säureamide [Erste Abhandlung.] In: Justus Liebigs Annalen der Chemie. Band 343, Nr. 2–3, 1905, S. 207–305, doi:10.1002/jlac.19053430207.
- Karl Brunner: Eine neue Darstellungsweise von Triazolen. In: Monatshefte für Chemie und verwandte Teile anderer Wissenschaften. Band 36, Nr. 7–8, Juli 1915, S. 509–534, doi:10.1007/BF01524682.
- M. R. Atkinson, J. B. Polya: Triazoles. Part II. N-substitution of some 1 : 2 : 4-triazoles. In: Journal of the Chemical Society. (Resumed), 1954, S. 141–145, doi:10.1039/JR9540000141.
- K. T. Potts: The Chemistry of 1,2,4-Triazoles. In: Chemical Reviews. Band 61, Nr. 2, April 1961, S. 87–127, doi:10.1021/cr60210a001.