Distickstofftrioxid
Distickstofftrioxid ist eine chemische Verbindung mit der Formel N2O3 aus der Gruppe der Stickoxide. Es ist das formale Anhydrid der Salpetrigen Säure. Unterhalb von 3 °C liegt es als tiefblaue Flüssigkeit vor, die bei −100,7 °C zu einem blassblauen Feststoff erstarrt.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
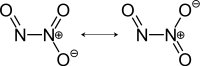 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Distickstofftrioxid | ||||||||||||||||||
| Andere Namen |
Salpetrigsäureanhydrid, veraltet: Stickstofftrioxid | ||||||||||||||||||
| Summenformel | N2O3 | ||||||||||||||||||
| Kurzbeschreibung |
tief dunkelblaue Flüssigkeit bei −21 °C[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 76,01 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
instabil bei Standardbedingungen[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
−40 – +3 °C (teilweise Zersetzung)[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Eigenschaften
Distickstofftrioxid ist bei Normdruck oberhalb von −40 °C instabil, da es beim Sieden in Stickstoffmonoxid NO und Stickstoffdioxid NO2 (bzw. dessen Dimer N2O4) dissoziiert. Dadurch steigt der Siedepunkt der Mischung bis auf +3 °C an.
- ΔfH0gas: 91,2 kJ·mol−1
- S0gas, 1 bar: 314,63 J·(mol·K)−1
Herstellung
Distickstofftrioxid wird durch Kontakt gleicher Mengen Stickstoffmonoxid (NO) und Stickstoffdioxid (NO2) erzeugt, wobei die Mischung unter −21 °C abgekühlt wird. Die beiden Gase reagieren miteinander und verbinden sich zu der tiefblauen Flüssigkeit Distickstofftrioxid mit der Formel N2O3.
Eine bequeme Herstellungsmethode ist, pulverförmiges Arsentrioxid mit Salpetersäure zu versetzen:[4]
Es entsteht auch bei 20 °C als Gas, wenn man festes Natriumnitrit in konz. Salpetersäure reagieren lässt.[5]
Verwendung
Distickstofftrioxid ist das Anhydrid der Salpetrigen Säure HNO2. Diese entsteht auch, wenn Distickstofftrioxid in Wasser (H2O) eingebracht wird. Sie zerfällt jedoch bei nicht zeitnaher Weiterverarbeitung zu Stickstoffmonoxid NO sowie Salpetersäure HNO3. Nitrite, die Salze der Salpetrigen Säure, werden manchmal durch Zugabe von Distickstofftrioxid zu den jeweiligen Basen hergestellt.
Sicherheitshinweise
Die Zerfallsprodukte von Distickstofftrioxid sind giftig beim Einatmen.[1] Bei Kontakt mit dem Auge sind schwere Schädigungen die Folge.
Einzelnachweise
- Eintrag zu Stickstoffoxide. In: Römpp Online. Georg Thieme Verlag, abgerufen am 17. April 2014.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 696.
- Für diesen Stoff liegt noch keine harmonisierte Einstufung vor. Wiedergegeben ist eine von einer Selbsteinstufung durch Inverkehrbringer abgeleitete Kennzeichnung von Dinitrogen trioxide im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 13. Januar 2020.
- G. Brauer (Hrsg.): Handbook of Preparative Inorganic Chemistry. 2. Auflage. Band 1, Academic Press 1963, S. 487–488.
- R. Stoermer und B. Kahlert: Ueber das 1- und 2-Brom-cumaron. In: Berichte der deutschen chemischen Gesellschaft. 35, 1633–1640 (1902), doi:10.1002/cber.19020350286, Seite 1638



