Dirucotid
Dirucotid, auch als MBP8298 bekannt, ist ein experimenteller immunmodulatorischer Arzneistoff, der zur Behandlung schubförmiger und chronischer Verlaufsformen der multiplen Sklerose (MS) erprobt wurde. Bei Dirucotid handelt es sich um ein synthetisches Peptid, das aus den Aminosäuren 82–98 des basischen Myelinproteins („MBP“) besteht.
| Dirucotid | ||
|---|---|---|
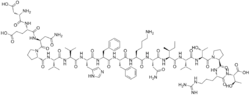 | ||
| Masse/Länge Primärstruktur | 2013,29 g·mol−1 | |
| Bezeichner | ||
| Externe IDs |
| |
Wirkprinzip
Als nachgeahmtes Myelineiweiß soll Dirucotid die bei MS fehlgeleitete Immunreaktion gegen die Schutzhülle der Nervenbahnen (Myelinscheide) auf sich lenken und allmählich vermindern und so die Immuntoleranz wiederherstellen.[1]
Der Hauptangriffspunkt der MS-relevanten B- und T-Zellen ist in der Sequenz 82 bis 98 des synthetischen MBP kodiert. Damit sollen diese B- und T-Zellen neutralisiert werden und zusätzlich die Ausschüttung autoaggressiver Antikörper vermindert werden.
Es wird angenommen, dass nur Patienten, die bestimmte Genvarianten in sich tragen (HLA DR2/DR4 Haplotyp), von der Behandlung mit Dirucotid profitieren. Dies trifft auf etwa 65–75 % der an MS erkrankten Menschen zu. In der Gesamtbevölkerung liegt die Wahrscheinlichkeit nur zwischen 20 und 30 %.
Klinische Entwicklung
Dirucotid wurde an der kanadischen Universität von Alberta in Edmonton entdeckt. Der Arzneistoff wurde danach an die ebenfalls in Edmonton ansässige Firma BioMS Medical auslizenziert. Seit Ende 2008 beteiligt sich die US-amerikanische Firma Lilly an der Entwicklung von Dirucotid.[2]
Der Arzneistoff wurde in einer kleineren Phase-II-Studie bei 32 Patienten mit progredienter MS über zwei Jahre doppelblind untersucht. In der Gesamtstudie konnte kein Unterschied zu Placebo gezeigt werden. Bei Beschränkung der Analyse auf die 20 Patienten, die Träger des HLA-Haplotyps DR2/DR4 sind, zeigte sich jedoch ein Nutzen der Behandlung mit Dirucotid. In einer Nachbeobachtung dieser 20 Patienten über weitere fünf Jahre deutete sich an, dass die mediane Zeit bis zum Fortschreiten der MS-Behinderung nach Behandlung mit Dirucotid von 18 auf 78 Monate verlängert werden konnte.[3]
2005 begann eine Phase-II/III-Studie zur Wirksamkeit von Dirucotid bei sekundär progredienter MS und 2006 eine Phase II-Studie bei schubförmiger MS.
In den Studien wird Dirucotid in Abständen von sechs Monaten intravenös injiziert.
Der Wirkstoff wurde in der veröffentlichten Studie gut vertragen.[3] Es traten lediglich Rötungen und Brennen an der Injektionsstelle auf.
Nachdem in einer Phase-III Studie zur SPMS der primäre- und einige sekundäre Endpunkte nicht erreicht wurden, sind alle Studien zu Dirucotid abgebrochen worden.[4]
Weblinks
- Einträg. In: NIH-Studienregister
- Wissenschaftliche Information über MBP8298. (Memento vom 13. Januar 2006 im Internet Archive) (englisch)
Einzelnachweise
- K. G. Warren, I. Catz, K. W. Wucherpfennig: Tolerance induction to myelin basic protein by intravenous synthetic peptides containing epitope P85 VVHFFKNIVTP96 in chronic progressive multiple sclerosis. In: J Neurol Sci. 152, 1997, S. 31–38. PMID 9395124
- K. Riddell: BioMS May Give Lilly $5 Billion Cure for Expiring Drug Patents. bloomberg.com, 26. Dezember 2008; abgerufen am 30. Dezember 2008.
- K. G. Warren, I. Catz, L. Z. Ferenczi, M. J. Krantz: Intravenous synthetic peptide MBP8298 delayed disease progression in an HLA Class II-defined cohort of patients with progressive multiple sclerosis: results of a 24-month double-blind placebo-controlled clinical trial and 5 years of follow-up treatment. In: Eur J Neurol. 13, 2006, S. 887–895. PMID 16879301
- BioMS scrap MS drug after trial fails