Thorpe-Ziegler-Reaktion
Die Thorpe-Ziegler-Reaktion (auch als Thorpe-Ziegler-Ringschlußverfahren oder nur Thorpe-Cyclisierung bekannt) ist eine Namensreaktion in der organischen Chemie und ist nach ihren Entdeckern, Jocelyn Thorpe und Karl Ziegler benannt. Die Reaktion verläuft analog zur Dieckmann-Kondensation, als Edukte werden jedoch keine Dicarbonsäureester, sondern α,ω-Dinitrile eingesetzt. Diese Reaktion hat viele Anwendungen in der Herstellung von Heterocyclen und macrocyclischen Ketonen. Bei der Thorpe-Ziegler Reaktion reagiert ein α,ω-Dinitril mit einer sterisch gehinderten Base zu einem cyclischen α-Ketonitril. Eine saure Hydrolyse des α-Ketonitrils liefert eine α-Ketocarbonsäure, die unter Decarboxylierung ein cyclisches Ketonen liefert.[1]
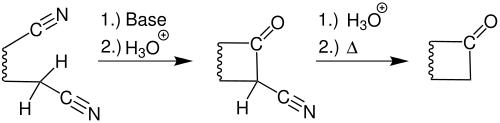
Wenn zwei C-H-acide Nitrile intramolekular analog miteinander reagieren, so läuft die Thorpe-Reaktion ab, diese Reaktion kann als eine Variante der Thorpe-Ziegler-Reaktion betrachtet werden.[2]
Mechanismus
Hinweise auf den möglichen Reaktionsmechanismus lieferten UV-Spektren, mit deren Hilfe man die sich bildenden Zwischenprodukte erkennen konnte.
Die geschlängelte Linie im Molekül soll eine Kohlenstoffkette variabler Länge bedeuten. An den beiden Enden dieser Kette hängt jeweils eine Nitrilgruppe, somit handelt es sich um ein α,ω-Dinitril 1. Versetzt man dieses Molekül mit einer sterisch gehinderten Base (hier Kalium-tert-butanolat), so wird eines der Kohlenstoffatome, an dem die Nitrilgruppe hängt, deprotoniert, wobei zugleich das tert-Butanolat zum tert-Butanol reagiert. Man erhält die deprotonierte Form des Dinitrils 2. Das soeben deprotonierte Kohlenstoffatom greift nun das Kohlenstoffatom der ω-Nitrilgruppe an. Dadurch bildet sich das cyclische Anion 3. Die Abstraktion eines Protons liefert dann das Imin 4. Durch die Zugabe von Säure wird dieses Stickstoffatom nun ein weiteres Mal protoniert, wodurch das Iminiumion 5 entsteht. An das Kohlenstoffatom des Iminiumions lagert sich nun ein Wassermolekül an, wodurch nun eine Oxoniumgruppe im Molekül entsteht. Außerdem lagert sich ein Elektronenpaar der Doppelbindung so zum Stickstoffatom um, dass das Iminiumion zur Aminogruppe wird 6. Das Stickstoffatom dieser Aminogruppe greift nun ein Wasserstoffatom der Oxoniumgruppe an. Dadurch wird die Oxoniumgruppe zur Hydroxygruppe und die Aminogruppe zur Ammoniumgruppe 7. Die Ammoniumgruppe spaltet sich nun vom Molekül ab und greift das Wasserstoffatom der Hydroxygruppe an, so dass sich ein Keton 8 mit einer Nitrilfunktion in der α-Position bildet. Die Reaktion kann an dieser Stelle unterbrochen werden, wodurch man ein cyclisches Keton mit einer Nitrilgruppe in α-Stellung zur Carbonylgruppe erhält.
Häufig soll die Nitrilfunktion in der α-Position des Ketons 8 abgespalten werden. Dazu wird die Nitrilgruppe in 8 über mehrere Schritte zur entsprechenden β-Ketocarbonsäure 9 hydrolysiert. Beim Erhitzen decarboxyliert 9 über einen sechsgliedrigen Übergangszustand und liefert die Enolform des cyclisches Ketons 10.
Die Herstellung von 9- bis 13-gliedrigen Ringen ist aufgrund transannularer Spannungen schwer, dementsprechend niedrig sind die Ausbeuten. Bei der Durchführung einer Thorpe-Ziegler Reaktion arbeitet man nach dem Ziegler-Ruggli-Verdünnungsprinzip stets in sehr verdünnter Lösung. So ist gewährleistet, dass die Wahrscheinlichkeit einer intermolekularen Reaktion geringer ist als die der gewünschten intramolekularen Reaktion. Dies basiert darauf, dass die Wahrscheinlichkeit, dass die Enden des gleichen Moleküls zueinander finden unabhängig von der Konzentration der Moleküle ist, während die Wahrscheinlichkeit, dass zwei Moleküle zueinander finden mit zunehmender Verdünnung abnimmt.
Eine wichtige Anwendung der Thorpe-Ziegler-Reaktion ist die Synthese von Thiamin. Dort wird sie zur Darstellung des Pyrimidinanteils verwendet. Dabei reagiert N′-Cyano-N-(2-cyanoethyl)acetamidin zu 4-Amino-2-methyl-1,6-dihydro-5-pyrimidincarbonitril. Dieses wird dann weiter zum eigentlich gewünschten Produkt, dem 4-Amino-5-aminomethyl-2-methylpyrimidin, umgesetzt.[3]
Einzelnachweise
- B. P. Mundy, M. G. Ellerd, F. G. Favaloro: Name Reactions and Reagents in organic Synthesis. 2. Auflage, Wiley-Interscience, Hoboken, NJ 2005, ISBN 978-0-471-22854-7, S. 646.
- Michael B. Smith: March’s Advanced Organic Chemistry. 7. Auflage, John Wiley & Sons, Hoboken, New Jersey, 2013, ISBN 978-0-470-46259-1, S. 1179.
- A. Edenhofer et al.: Studien über die Thorpe-Ziegler-Reaktion – Eine neue Synthese des Pyrimidinanteils von Thiamin. In: Helvetica Chimica Acta, 58(4), 1975, S. 1230–1240.