Benzvalen
Benzvalen ist eine instabile organische Verbindung und isomer zu Benzol.[3]
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
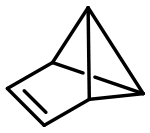 | ||||||||||
| Allgemeines | ||||||||||
| Name | Benzvalen | |||||||||
| Summenformel | C6H6 | |||||||||
| Kurzbeschreibung |
farblose, übel riechende Flüssigkeit[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 78,11 g·mol−1 | |||||||||
| Aggregatzustand |
flüssig[1] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Geschichte und Darstellung
Es wurde zuerst 1971 von Thomas J. Katz synthetisiert.[4][5] Die Synthese erfolgte durch Reaktion von Cyclopentadien mit Methyllithium in Dimethylether und anschließend mit Dichlormethan und Methyllithium bei −45 °C. Die entstehende Lösung besitzt einen fauligen Geruch. Durch die hohe sterische Spannung der Verbindung wandelt es sich innerhalb von kurzer Zeit in Benzol um und neigt zur explosiven Zersetzung.[6]
Eigenschaften
Benzvalen ist bei Raumtemperatur eine farblose, übel riechende und äußerst explosive Flüssigkeit, die jedoch bei 77 K und als Niederdruckdampf routinemäßig gehandhabt werden kann.[1]
Die Struktur ist exakt die durch die Wade'schen Regeln hervorgesagte Struktur von C6H6, das 6 × 3 = 18 Gerüstelektronen zur Verfügung hat, von welchen 6 × 2 = 12 für die bindenden Orbitale benötigt werden. Somit bleiben 6 × 1 = 6 Elektronen übrig, was einer arachno-Struktur des korrespondierenden Deltaeders mit 8 Ecken (Trigondodekaeder) entspricht, bei welchem zwei benachbarte Ecken entfernt wurden.[7]
Benzvalen polymerisiert durch eine ringöffnende metathetische Polymerisation zu Polybenzvalen,[6] welches als Zwischenprodukt zur Herstellung von Polyethin untersucht wird.
Durch photochemische Umsetzung kann Benzvalen zu Oxetanen umgesetzt werden.[8]
Einzelnachweise
- David W. T. Griffith, Jay E. Kent, M. F. O'Dwyer: The electronic spectrum of benzvalene. In: Journal of Molecular Spectroscopy. Band 58, Nr. 3, 1975, ISSN 0022-2852, S. 427–435, doi:10.1016/0022-2852(75)90222-2 (sciencedirect.com).
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Manfred Christl: „Benzvalene – Properties and Synthetic Potential“, in: Angewandte Chemie International Edition in English, 1981, 20 (6–7), S. 529–546; doi:10.1002/anie.198105291.
- Thomas J. Katz, E. Jang Wang, Nancy Acton: „Benzvalene synthesis“, in: J. Am. Chem. Soc., 1971, 93 (15), S. 3782–3783; doi:10.1021/ja00744a045.
- Thomas J. Katz, Ronald J. Roth, Nancy Acton, Eileen Jang Carnahan: „Synthesis of Benzvalene“, in: J. Org. Chem., 1999, 64 (20), S. 7663–7664; doi:10.1021/jo990883g.
- Lawrence T. Scott, Maitland Jones: „Rearrangements and interconversions of compounds of the formula (CH)n“, in: Chem. Rev., 1972, 72 (2), S. 181–202; doi:10.1021/cr60276a004.
- Thomas A. Albright, Jeremy K. Burdett, Myung-Hwan Whangbo: Orbital interactions in chemistry. Second edition Auflage. Wiley, Hoboken, New Jersey 2013, ISBN 978-0-471-08039-8.
- Manfred Christl, Max Braun: „Photocycloadditionen des Benzvalens“, in: Angewandte Chemie, 1989, 101 (5), S. 636–638; doi:10.1002/ange.19891010524.