Bislactimether-Verfahren
Das Bislactimether-Verfahren,[1] auch Schöllkopf-Methode oder Schöllkopf-Hartwig-Reaktion[2] genannt, bezeichnet in der Organischen Chemie eine Synthesemethode von optisch aktiven Aminosäuren. Die Methode wurde 1981 von dem deutschen Chemiker Ulrich Schöllkopf entwickelt.[3]
Reaktionsmechanismus
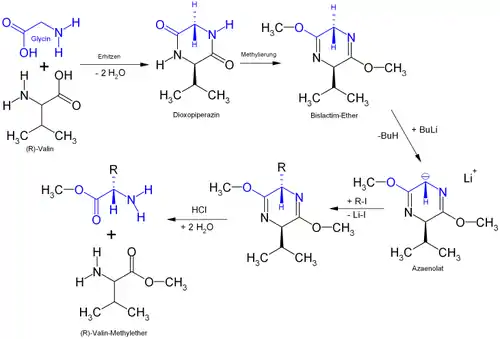
Glycin und Valin werden zu einem cyclischen Dipeptid (Dioxopiperazin) umgesetzt, das durch zweifache Methylierung in den Bislactimether überführt wird. Dies kann z. B. mithilfe von Trimethyloxoniumtetrafluoroborat bewerkstelligt werden. Aus diesem kann mit Butyllithium eines der aus Glycin stammenden prochiralen Protonen abstrahiert werden. Der folgende Schritt ist für die Stereoselektivität entscheidend: Das entstehende Carbanion ist auf der Oberseite durch den Isopropylrest des Valins sterisch stark gehindert und kann nur von unten angegriffen werden. Der Abfang des Anions mit einem Alkyliodid liefert daher immer das durch Rückseitenangriff erzeugte Enantiomer. Abschließend wird das Dipeptid durch saure Hydrolyse in die beiden Aminosäuremethylester gespalten, die voneinander getrennt werden.
Schöllkopf wählte mit Valin diejenige der natürlichen, proteinogenen Aminosäuren mit dem größten aliphatischen, nicht-reaktiven, nicht-chiralen Rest, um eine möglichst hohe Stereoselektivität zu erreichen. Im Regelfall sind Enantiomerenüberschüsse von etwa 95 % (ee) erreichbar.[2]
Möglichkeiten und Grenzen
Mit der Schöllkopf-Methode können alle Aminosäuren hergestellt werden, für die sich ein geeignetes Abfangreagenz (R-I) finden lässt, das unter den Reaktionsbedingungen zu dem gewünschten Produkt führt. Der Rest R ist dabei nicht auf Alkyl beschränkt, sondern kann auch komplizierter gebaut sein. Das Bislactimether-Verfahren findet ausschließlich als Laborverfahren zur Synthese kleiner Mengen exotischer Aminosäuren Anwendung. Eine industrielle Anwendung des Verfahrens ist nicht bekannt, da dessen Atomökonomie begrenzt ist.
Einzelnachweise
- Leo A. Paquette: Chiral Reagents for Asymmetric Synthesis. Wiley and Sons, 2003, ISBN 0-47085625-4, S. 220–223.
- Jan Bülle, Aloys Hüttermann: Das Basiswissen der organischen Chemie: Die wichtigsten organischen Reaktionen im Labor und in der Natur. Wiley-VCH, 2000, ISBN 3-52730847-4, S. 310/311.
- U. Schöllkopf, T. Tiller, J. Bardenhagen: Tetrahedron 1988, 44, 5293.