Berthelot-Reaktion
Die Berthelot-Reaktion benannt nach dem französischen Chemiker Marcelin Berthelot (1827–1907) ist die Reaktion von Ammoniak zum blaugefärbten Indophenol-Ion. Die Reaktion wird beim quantitativen Nachweis von Ammoniak bzw. Ammonium in wässriger Lösung verwendet.
Reagenzien
Für die Reaktion werden folgende Reagenzien benötigt:[1]
- Base:
Die Reaktion findet im alkalischen Medium statt. Deswegen muss vorher die Ammoniaklösung auf einen pH-Wert von ca. 13 gebracht werden - Chlorierungsmittel:
Hier hat sich Hypochlorit (OCl−) als brauchbar herausgestellt. Nach DIN ist allerdings Dichlorisocyanursäure zu verwenden. - Phenol:
Für den Mechanismus ist es egal, welche Phenolverbindung verwendet wird. In der Praxis hat sich Thymol (2-Isopropyl-5-methylphenol) wegen seiner höheren Stabilität und Geschwindigkeit bewährt. Hier verlangt die DIN Natriumsalicylat. - Katalysator:
Zur Katalyse der Reaktion wird meistens der Komplex Nitroprussid verwendet. Es ist möglich, Mn(II)-Ionen als weniger giftige Alternative einzusetzen, allerdings liegt das Temperaturoptimum dann bei ca. 80 °C, was mit vielen Standardmessgeräten nicht realisierbar ist.[2]
Mechanismus
Da die Reaktion im alkalischen Medium (pH = 13) stattfindet, liegt sämtliches Ammoniak als NH3 vor, weil sich das Gleichgewicht der Reaktion nach dem Prinzip von Le Chatelier stark auf die Seite von Ammoniak verlagert:
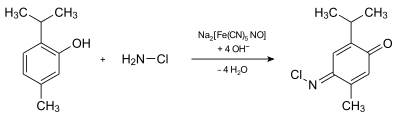
Ammoniak reagiert im zweiten Schritt mit Hypochlorit zu Monochloramin:
Im dritten Schritt reagiert das Monochloramin mit Thymol zu N-Chlor-2-isopropyl-5-methylchinon-monoimin. (Diese Reaktion wird vom Nitroprussid katalysiert.)
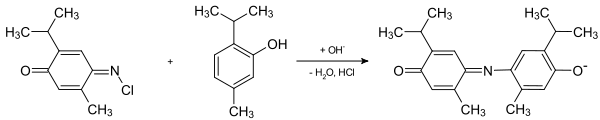
Im vierten Schritt reagiert N-Chlor-2-isopropyl-5-methylchinon-monoimin mit einem weiteren Thymolmolekül zum entsprechenden Indophenol. Im alkalischen Medium liegt das entstandene Indophenolmolekül in seiner blauen Basenform vor:
Konzentrationsbestimmung
Die Konzentration kann photometrisch bestimmt werden. Die Bestimmungsgrenzen für dieses Verfahren liegen bei ca. 0,01 mg/l und bei ca. 3,5 mg/l Ammonium/Ammoniak.
Einzelnachweise
- B. Känel, K. Mez, Microbial Ecology Group der Universität Zürich, Laboratory Methods, Ammonia colorimetric (Seite nicht mehr abrufbar, Suche in Webarchiven) Info: Der Link wurde automatisch als defekt markiert. Bitte prüfe den Link gemäß Anleitung und entferne dann diesen Hinweis. (PDF; 8 kB).
- Tsuboi, T.; Hirano, Y.; Shibata, Y.; Motomizu, S.: Sensitivity Improvement of Ammonia Determination Based on Flow-Injection Indophenol Spectrophotometry with Manganese(II) Ion as a Catalyst and Analysis of Exhaust Gas auf Thermal Power Plant. In: Analytical Sciences, October 2002, Vol. 18, S. 1141–1144.doi:10.2116/analsci.18.1141