Bergbaubedingte Versauerung von Grund- und Oberflächenwasser
Entstehung
Ein Problem des Erz- und Kohle-Bergbaus ist die Bildung von sauren Grubenwässern. Diese entstehen, wenn durch die bergbauliche Tätigkeit Sauerstoff in anoxische Gebirgsbereiche gelangt und oxidierend auf dort lagernde Eisendisulfidminerale Pyrit und Markasit einwirkt. Diese Oxidationen werden durch Bakterien und Archaeen katalysiert. Die abiotische Oxidation verläuft nur sehr langsam. Das Eisen wird zu Eisen(III)-Ionen oxidiert und freigesetzt und der Sulfid-Schwefel wird zu Sulfat-Ionen oxidiert, wobei Protonen H+ freigesetzt werden:
- (Gl. 1)
In saurem Sickerwasser können gelöste Eisen(III)-Ionen selbst als Oxidationsmittel wirken. Bei pH-Werten von über etwa 2,7 bis 3,0 setzen sich die Eisen(III)-Ionen mit Wasser, Sulfat-Ionen und gegebenenfalls mit weiteren Ionen zu Eisen(III)hydroxid (Fe(OH)3) bzw. Jarositen (beispielsweise KFe3III[(OH)6|(SO4)2]) um, wobei ebenfalls Protonen H+ freigesetzt werden:
- (Gl. 2)
Eisen(III)hydroxid und Jarosite sind schwer wasserlöslich und fallen deshalb in Form eines braunen Niederschlags aus.
Andere Metallsulfid-Minerale werden bei Einwirken von Sauerstoff ebenfalls oxidativ gelöst:
- Hierin steht Me für ein zweiwertiges Metall (z. B. Zn, Pb, Ni, Cu)
Die Bildungsmechanismen unterscheiden sich im Tagebau und Untertagebetrieb prinzipiell nicht. Ein Tagebaurestloch füllt sich in der Folge mit saurem, sulfat- und metallhaltigem Wasser. Noch problematischer ist im Umfeld des Erzbergbaus die mögliche Anreicherung des sauren Wassers mit (Semi-)metallionen.
Der pH-Wert ist kein zuverlässiges Kriterium für die Kontamination des Wassers mit Pyritverwitterungsprodukten, da sich bergbauversauerte Grund- und Oberflächenwässer vor allem im pH-Wert voneinander unterscheiden.
Unter Sauerstoffmangel reichern sich zunehmend zweiwertige Eisen-Ionen (Fe2+) an, da sie wegen des Sauerstoffmangels nicht zu dreiwertigen Eisen-Ionen oxidiert werden, weshalb weniger (Protonen H+) freigesetzt werden, also weniger Säure gebildet wird.
- (Gl. 3)
Im Abraum ebenfalls vorhandene puffernde Minerale wie Karbonate (z. B. Calcit, Dolomit, Siderit) lösen sich unter Aufnahme von Protonen auf, wobei das Sickerwasser neutralisiert wird, d. h. der pH-Wert ansteigt.
- (Gl. 4)
Über Tonmineralverwitterung und Ionenaustausch (z. B. H+ gegen Na+) werden weitere bei der Pyritverwitterung gebildete Protonen abgebunden. Die Kippengrundwasserbeschaffenheit zeigt meist eine deutliche vertikale Gliederung, die nicht immer mit der geologischen Abgrenzung der Kippe zum gewachsenen Tertiärgrundwasserleiter übereinstimmt.
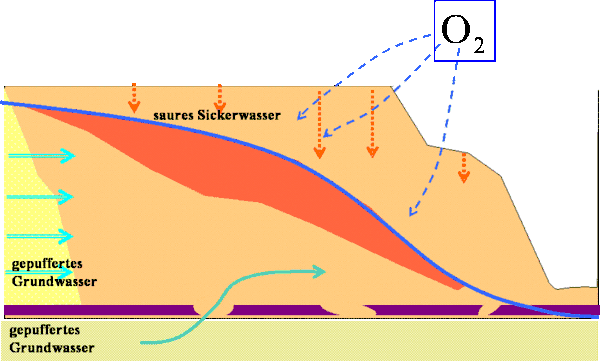
Schließlich entsteht ein nahezu sauerstofffreies Grundwasser mit hohen Sulfat- und Eisen(II)-Konzentrationen (im Extremfall jeweils >1000 mg/L) mit pH > 4. Der pH-Wert liegt dabei im Bereich der unbeeinflussten Grundwässer. Das bei der Pyritverwitterung gebildete Fe2+ ist ein potentieller Säurebildner. Von außen und aus dem Liegenden strömt unbeeinflusstes Grundwasser ein.
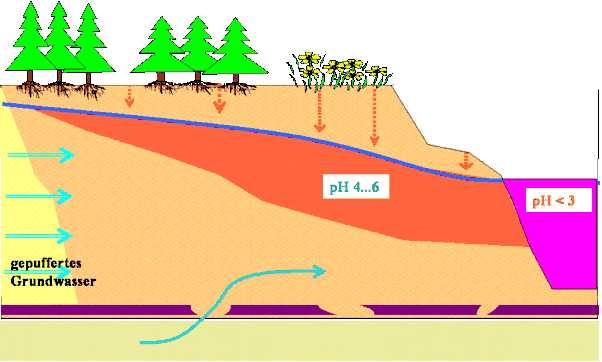
Erst nach Belüftung dieses potenziell sauren Kippengrundwassers wird durch Oxidation des Eisen(II) und der Umsetzung des gebildeten Eisen(III) zu Eisen(III)hydroxid die potenzielle Säure freigesetzt und es entsteht das saure Wasser im Tagebausee.
- (Gl.5)
und
- (Gl. 2)
Bei der Oxidation und Fällung von 1 mmol/L oder 56 mg/L Eisen(II) aus dem Grundwasser werden also 2 mmol/L Wasserstoffionen gebildet, der pH-Wert kann bis auf < 2,7 absinken. Zuerst wird das puffernde Hydrogencarbonat umgesetzt (Hydrogencarbonatpuffer).
- (Gl. 6)
Eisen(III) ist bei niedrigen pH-Werten im Wasser begrenzt löslich und steht im chemischen Gleichgewicht mit gefälltem Eisenhydroxid. Sulfat bildet über pH etwa 1 mit den Wasserstoffionen Hydrogensulfat (HSO4−).
- (Gl. 7)
Die maximale pH-Stabilisierung wird um pH ≈ 2,0 erreicht, wo die Hälfte des Gesamtsulfates als Hydrogensulfat vorliegt.
Betrachtung der Versauerungsprozesse
Das Neutralisationspotenzial
Die Bilanzierung der in das Grund-/Sickerwasser eingetragenen Säure erfolgt in der Regel über das Aciditätskonzept (Stumm & Morgan 1996). Als Acidität Aci einer wässrigen Lösung wird der Überschuss an starken Säuren im Vergleich zu starken Basen bezeichnet. Kirby & Cravotta (2005) und Kirby & Cravotta (2005 a) diskutieren ausführlich verschiedenste Aciditäts- und Alkalitätsdefinitionen. Aus verschiedenen Titrations- und Berechnungsverfahren mit unterschiedlicher Berücksichtigung des gelösten anorganischen Kohlenstoffs (DIC) oder der Kationensäuren (Fe, Mn, Al) resultiert eine verwirrende Zahl von Begriffen. Deshalb wird hier auf die Definition des Neutralisationspotenzials (NP) nach Evangelou (1995), modifiziert von Schöpke (1999), zurückgegriffen (alle Konzentrationen c in mmol/L):
- (Gl.8)
Dabei wird die Säurekapazität bis pH = 4,3 ( ) mit Säure, bzw. Base titriert und enthält folgende Ionenkonzentrationen:
- (Gl.9)
Da die zweiwertigen Eisen- und Manganionen, sowie Aluminium nicht mit der Säurekapazität erfasst werden, sind sie rechnerisch zu berücksichtigen. Fallweise sind weitere bis pH ≈ 7 hydrolysierende (Semi-)metalle, wie z. B. Zn, mit zu berücksichtigen.
Der Wert des Neutralisationspotenzials ist für Kippengrundwässer und das daraus gebildete Seewasser gleich. Bei der Lösung/Fällung von Eisenhydroxid oder der Oxidation von Eisen(2) wird der pH-Wert verändert, die Acidität des Wassers, in der Summe von Protonen, Eisen(2) und Eisen(3) bleibt aber gleich.
Vektordarstellung der Bildungsprozesse von sauren Bergbauwässern
Die mit der Genese von bergbaubeeinflussten Wässern im Zusammenhang stehenden Reaktionen lassen sich auch als Vektoren in der Diagrammebene des negativen Neutralisationspotenzials (-NP) gegen die Sulfatkonzentration darstellen. Bei der Bildung von AMD aus ionenarmem Niederschlagswasser überlagern sich die Oxidationsreaktionen der Sulfide mit puffernden Reaktionen und unter Umständen auch mit der Fällung/Lösung von Gips. Dadurch wird der Mineraleintrag (Hauptanion Sulfat) in das Wasser mit der Aciditätsbildung verknüpft. Dargestellt wird das negative Neutralisationspotenzial, das mit der auch üblichen Angabe Acidität in Richtung Versauerung weist.
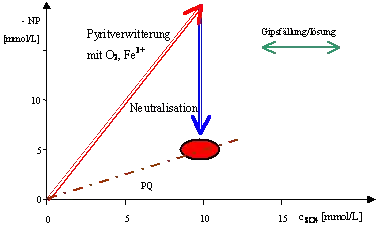
Die Vektoren repräsentieren Konzentrationsänderungen. Aus ihrer Länge lassen sich Stoffeinträge oder andere Reaktionen quantitativ ablesen. Veränderungen in der Wasserbeschaffenheit lassen in diesem Diagramm auf die dargestellten Grundprozesse (Pyritverwitterung, Neutralisation und Gipsfällung/-lösung) zurückführen. Dabei ist die dargestellte Pyritverwitterung ein Maßstab für die bergbaubedingte Versauerung:
- Pyritverwitterung nach Gl.1 und Gl.3
- Oxidation mit Eisen(3)
- Gl.(10)
- Oxidation mit Wasserstoffperoxid, zum Beispiel im Labor:
- Gl.(11)
- Oxidation mit Nitrat:
- Gl.(12)
Dieser (nichteingezeichnete) Vektor hat nur eine Steigung von 0,6 (0,6 H+ pro Sulfat). Die Pyritoxidation mit Nitrat kann auch hohe Grundwassereisenkonzentrationen infolge von Überdüngung verursachen.
- Eintrag von festen oder am Boden adsorbierten Pyritverwitterungsprodukten
Bei der Neutralisation (Pufferungsreaktionen) wird die Sulfatkonzentration nicht verändert.
- Calcitumsetzung mit Säure nach Gl.4
- Laugezugabe
- Gl.(13) oder
- Gl.(14)
Reaktionen die das Neutralisationspotenzial (Acidität) nicht verändern:
- Oxidation des Eisen(2) nach Gl.5
- Reduktive Lösung von Eisenhydroxid, z. B. durch Kohlenhydrate
- Gl.(15)
- Fällung/Lösung von Eisen(3)hydroxid nach Gl.2
- Fällung/Lösung von Eisencarbonat (Siderit)
- Gl.(16)
- Fällung/Lösung von Aluminiumhydroxid
- Gl.(17)
Bei der Oxidation von Eisen(II) durch Sauerstoff ändert sich nach Definition das Neutralisationspotenzial nicht. Das gilt auch für die Umkehrreaktion mit sauerstoffzehrenden Stoffen nach Gl.15. Im Gleichgewicht mit den Eisenspecies stehende Mineralphasen nach Gl.5, Gl.16 und Gl.17 verändern ebenfalls nicht die Acidität, wohl aber den pH-Wert. Diese Reaktionen erscheinen im Vektordiagramm nicht oder stellen genau genommen einen Punkt dar. Die genaue Zusammensetzung eines bergbauversauerten und teilneutralisierten Wassers wird aber durch eine Vielzahl nicht das Neutralisationspotenzial oder die Sulfatkonzentration beeinflussende Reaktionen geprägt. Durch die vorgestellte Vektordarstellung lassen sich alle für die Einschätzung der Bergbauversauerung weniger wichtigen Vorgänge ausblenden. Kippengrundwasser und das zugehörige saure Seewasser mit unterschiedlichen Beschaffenheiten sind deckungsgleich. Dadurch lassen sich zum Beispiel Sanierungsmaßnahmen zielgerichten vorbereiten.
Die hydrochemischen Details muss man sich über geochemische Modellierung, beispielsweise mit PHREEQC nach Parkhurst & Appelo(2006), schrittweise erschließen.
Analysenbeispiele
Die Zusammensetzungen von Grund- und Oberflächenwässern schwanken in weiten Grenzen. Zur Veranschaulichung werden nachfolgend Daten von Lausitzer Wässern (Schöpke 1999) und einem Grubenwasser des Untertagebergbaus (Gammons et al. 2006) zusammengestellt:
| Parameter | Einheit | Grundwasser | Kippengrundwasser | Tagebausee | Grubenwasser |
|---|---|---|---|---|---|
| pH | 1 | 7 | 4,5…6,4 | 2,8 | 4,6 |
| elektrische Leitfähigkeit | µS/cm | 400 | 800…3000 | 2900 | 6200 |
| KS4,3 | mmol/l | 1,6 | 0,5…4 | −3,8 | |
| Ca | mg/L | 80 | 140…700 | 300 | 490 |
| Mg | mg/L | 6 | 11…50 | 24 | 400 |
| Fe | mg/L | 12 | 50…2000 | 130 | 1770 |
| SO42− | mg/L | 100 | 500…3600 | 1300 | 7700 |
| Neutralisationspotential (NP) | mmol/L | >0,5 | −70…0 | −11 | −83 |
Das Grubenwasser des Untertagebergbaus weist sehr hohe Konzentrationen an Mangan, Aluminium und (Semi-)metallen auf, die bei der Berechnung des Neutralisationspotenzials mit berücksichtigt worden sind.
- Genese von Kippengrundwässern
- Darstellung der Hydrochemie von Sanierungsmaßnahmen
Siehe auch
Literatur
- V. P. Evangelou: Pyrite oxidation and its control. CRC Press, Boca Raton/ New York/ London/ Tokio 1995, ISBN 0-8493-4732-7.
- C. H. Gammons, J. J. Metesh, D. M. Snyder: A Survey of the Geochemistry of Flooded Mine Shaft Water in Butte, Montana. In: Mine Water and the Environment. 25, Nr. 2, 2006, S. 100–107.
- C. S. Kirby, C. A. Cravotta: Net alkalinity and net acidity 2: PRACTICAL considerations. In: Applied Geochemistry. Vol. 20, Nr. 10, 2005, S. 1941–1964.
- C. S. Kirby, C. A. Cravotta: Net alkalinity and net acidity 1: Theoretical considerations. In: Applied Geochemistry. Vol. 20, Nr. 10 2005, S. 1920–1940.
- D. L. Parkhurst, C. A. J. Appelo: PHREEQC Version 3. (= Water-Resources Investigations Report 99-4259).[1] 2006.
- R. Schöpke: Erarbeitung einer Methodik zur Beschreibung hydrochemischer Prozesse in Kippengrundwasserleitern. (= Siedlungswasserwirtschaft und Umwelt. Heft 2).[2]
- R. Schöpke, W. Pietsch: Chemisch bedingte Beschaffenheitsveränderungen des Sicker- und Grundwassers (Abschlussbericht Teilprojekt 10). In: BTUC: Innovationskolleg. Ökologisches Entwicklungspotential der Bergbaufolgelandschaften im Lausitzer Braunkohlerevier. B.G. Teubner Stuttgart/ Leipzig/ Wiesbaden 2000, ISBN 3-519-00321-X.
- W. Stumm, J. J. Morgan: Aquatic chemistry - Chemical Equilibria and Rates in Natural Waters. 3. Auflage. John Wiley, New York 1996, ISBN 0-471-51184-6.
- Ch. Wolkersdorfer: Water Management at Abandoned Flooded Underground Mines – Fundamentals, Tracer Tests, Modelling, Water Treatment. Springer, Berlin 2008, ISBN 978-3-540-77330-6.
- P. L. Younger, S. A. Banwart, R. S. Hedin: Mine Water – Hydrology, Pollution, Remediation. Kluwer, Dordrecht 2002, ISBN 1-4020-0137-1.
- P. L. Younger, N. S. Robins: Mine Water Hydrogeology and Geochemistry. (= Spec. Publ. – Geol. Soc. London. 198). London 2002, ISBN 1-86239-113-0.
Weblinks
Einzelnachweise
- (usgs.gov)
- Brandenburgische Technische Universität Cottbus (Memento vom 4. März 2016 im Internet Archive) (PDF-Datei; 2,82 MB). Dissertation BTU Cottbus LS Wassertechnik, 1999.