Benzylester
Benzylester sind chemische Verbindungen, die zur Gruppe der Carbonsäureester gehören. Sie entstehen durch Veresterung einer Carbonsäure mit Benzylalkohol (PhCH2OH). Sie weisen die charakteristische funktionelle Estergruppe auf. Im weiteren Sinne zählen zu den Benzylestern auch Kohlensäureester und Ester, die sich von Sulfonsäuren und Benzylalkohol ableiten. Analog können sich auch aus Salpetersäure, Sulfinsäuren, Phosphonsäuren oder Phosphinsäuren einerseits und Benzylalkohol andererseits Benzylester im weiteren Sinne bilden.
Vorkommen

Ameisensäurebenzylester kommt natürlich in verschiedenen Pflanzen und Pilzen (zum Beispiel der Kartoffel-Rose, Kaffee, Vanille) vor.[1]
Herstellung
Benzylester entstehen z. B. aus einer Carbonsäure und Benzylalkohol unter säurekatalysierter Wasserabspaltung. Aus Carbonsäurechloriden und Benzylalkohol können nach der Schotten-Baumann-Methode ebenfalls Benzylester erhalten werden. Benzylester lassen sich auch aus Carbonsäureanhydriden und Benzylalkohol synthetisieren. Die nucleophile Substitution von Benzylhalogeniden (z. B. Benzylbromid 2) mit Alkalisalzen von Carbonsäuren (z. B. Benzoesäurenatriumsalz 1) führt zum Benzylester 3 der Benzoesäure:[2]
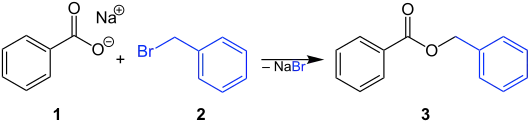
Bei Nutzung von Phasentransferkatalysatoren kann unter milderen Bedingungen und mit höheren Ausbeuten gearbeitet werden.[3]
Verwendung als Schutzgruppe
In der organischen Synthesechemie und besonders in der Peptidsynthese wird die Benzyloxycarbonylgruppe mit Benzylchlorformiat in Gegenwart einer schwachen Base eingeführt. Die Cbz-Gruppe lässt sich zum Schützen einer Aminogruppe einfach in ein Molekül einführen, indem das Amin (z. B. die Aminosäure 2) mit Benzyloxycarbonylchlorid 1 in Gegenwart einer schwachen Base umsetzt. Dabei entsteht eine Cbz-geschützte Aminosäure 3:[4]
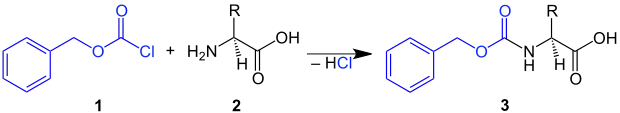
Das geschützte Amin (z. B. in 3) kann durch katalytische Hydrierung unter hydrogenolytischer Spaltung der Benzyl-Sauerstoff-Bindung mit anschließender Decarboxylierung der so entstehenden instabilen Carbaminsäure oder Behandlung mit Säuren wieder entschützt werden.
Einzelnachweise
- George A. Burdock: Fenaroli's Handbook of Flavor Ingredients, Fifth Edition:. CRC Press, 2004, ISBN 978-1-4200-3787-6, S. 1927 (eingeschränkte Vorschau in der Google-Buchsuche).
- Siegfried Hauptmann: Organische Chemie, 2. durchgesehene Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig 1985, ISBN 3-342-00280-8, S. 402.
- Klaus Schwetlick u. a.: Organikum. 24. Auflage. Wiley-VCH, Weinheim 2015, ISBN 978-3-527-33968-6.
- Siegfried Hauptmann: Organische Chemie, 2. durchgesehene Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig, 1985, S. 661, ISBN 3-342-00280-8.