Balz-Schiemann-Reaktion
Die Balz-Schiemann-Reaktion (auch als Schiemann-Reaktion bekannt) ist eine Namensreaktion der Organischen Chemie, die nach ihren Entdeckern Günther Balz und Günther Schiemann (1899–1967) benannt wurde.
Übersichtsreaktion
Die Balz-Schiemann-Reaktion ist die wichtigste Reaktion zur Einführung eines Fluorsubstituenten in einen Aromaten, der über eine Aminogruppe verfügt.[1] Die Reaktion läuft unter Zugabe von salpetriger Säure und Tetrafluoroborsäure ab.[2]

Reaktionsmechanismus
Der folgende Reaktionsmechanismus wurde unter anderem von Jie Jack Li vorgeschlagen. Zunächst dissoziiert die Tetrafluoroborsäure in einem inerten Lösungsmittel zu einem Tetrafluoroboratanion und einem Proton. Die Hydroxygruppe der salpetrigen Säure wird protoniert. Nachdem aus dem entstehenden Oxoniumion Wasser abgespalten wurde, entsteht ein Nitrosylkation. Das Tetrafluoroboratanion (blau) bleibt in Lösung.[3]
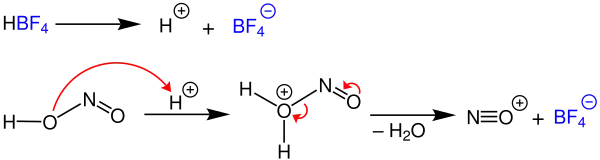
Als Beispiel für einen Arylrest wurde ein Phenylrest mit einer substituierten Aminogruppe 1 verwendet. Das nicht-bindende Elektronenpaar des Stickstoffatoms der Aminogruppe greift das Nitrosylkation an. Unter Deprotonierung wird Struktur 2 gebildet. Durch intramolekulare Umlagerungsreaktionen entsteht Struktur 3, welche anschließend zum Oxoniumion 4 protoniert wird.
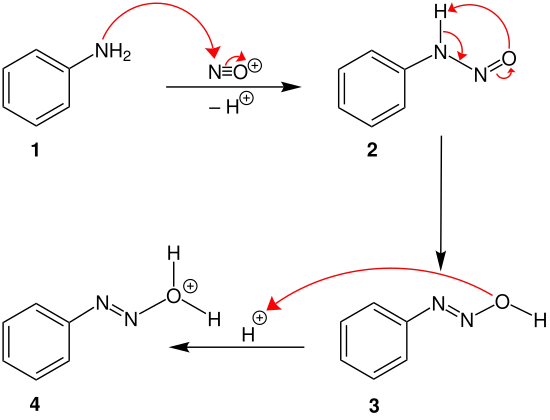
Unter Abspaltung von Wasser bildet sich das Diazoniumsalz 5. Dieses wird gefällt, gewaschen und getrocknet. Anschließend kann durch vorsichtiges Erhitzen Stickstoff (N2) abgespalten werden, wodurch das sekundäre Carbeniumion 6 entsteht.
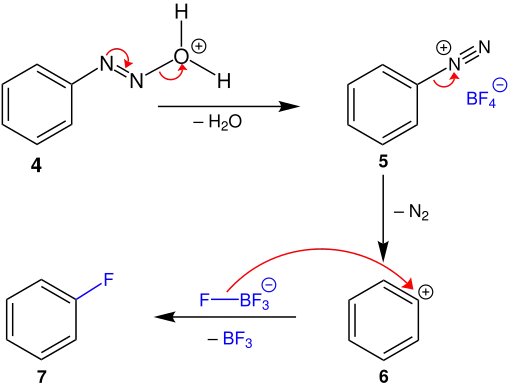
Im letzten Schritt wird ein Fluoratom an 6 addiert, wobei ebenfalls gasförmiges Bortrifluorid freigesetzt wird. Dieses kann als Borfluorwasserstoffsäure oder Kaliumborfluorid wiedergewonnen werden.[4]
Praktische Bedeutung
Die Sandmeyer-Reaktion ermöglicht es, Arylreste zu bromieren und zu chlorieren. Die Fluorierung von Arylresten gelingt durch die Balz-Schiemann-Reaktion. Der Vorteil dieser Reaktion ist die sehr ruhig und glatt verlaufende Zersetzung des Diazoniumborfluorids, das schwerlöslich, leicht isolierbar ist und sogar umkristallisiert werden kann. Außerdem treten keine Nebenreaktionen auf, sodass hohe Ausbeuten erzielt werden können. Vergleichbare Diazoniumborhalogenide, vor allem Diazoniumborchloride, sind hoch explosiv.[5] Die Kohlenstoff-Fluor-Bindung erhöht die Lipophilie einer Verbindung und spielt darum eine wichtige Rolle bei Prozessen der Blut-Hirn-Schranke in Bezug auf Psychopharmaka. Außerdem ist Fluor ein starker Wasserstoffbrückenakzeptor, der bestimmte Konformationen einer Verbindung (z. B. die 3D-Struktur von Proteinen) begünstigen kann.
Einzelnachweise
- Flood, D. T.: Fluorobenzene In: Organic Syntheses. 13, 1933, S. 46, doi:10.15227/orgsyn.013.0046; Coll. Vol. 2, 1943, S. 195 (PDF).
- Günther Balz, Günther Schiemann: In Über aromatische Fluorverbindungen, I.: Ein neues Verfahren zu ihrer Darstellung, Chemische Berichte 1927, 5, 1186–1190, doi:10.1002/cber.19270600539.
- Michael P. Doyle, William J. Bryker: Alkyl Nitrite-Metal Halide Deamination Reactions.6.Direct Synthesis of Arenediazonium Tetrafluoroborate Salts from Aromatic Amines, tert-Butyl Nitrite, and Boron Trifluoride Etherate in Anhydrous Media, The Journal of Organic Chemistry 1978, 9, 1572–1574, doi:10.1021/jo01323a048.
- C. Gardner Swain, Randall J. Rogers: Mechanism of Formation of Aryl Fluorides from Arenediazonium Fluoborates, Journal of the American Chemical Society 1974, 4, 799–800, doi:10.1021/ja00837a019.
- Günther Balz, Günther Schiemann: In Über aromatische Fluorverbindungen, I.: Ein neues Verfahren zu ihrer Darstellung, Chemische Berichte 1927, 60, 1186–1190, doi:10.1002/cber.19270600539.
Literatur
- L. Gattermann, H. Wieland: Die Praxis des organischen Chemikers, 43. Auflage, de Gruyter, Berlin 1982, S. 617 ISBN 3-11-006654-8.
- Jie Jack Li: Name reactions, a collection of detailed reaction mechanism.Vol 1.Springer 2002. ISBN 3-540-43024-5.
- Z. Wang: Comprehensive Organic Name Reactions and Reagents, Vol 1. John Wiley & Sons, Hoboken, New Jersey 2009, S. 185–190, ISBN 978-0-471-70450-8.