Australischer Amethystpython
Der Australische Amethystpython (Simalia kinghorni, Syn.: Morelia kinghorni), auch Kinghorns Python, zählt zur Familie der Pythons (Pythonidae) und wird dort in die Gattung der Amethystpythons (Simalia) gestellt. Er wurde erst im Jahr 2000 als eigene Art vom Amethystpython abgetrennt. Mit gesicherten Längen über fünf Meter ist dieser schlanke Python die weitaus größte Schlange Australiens und gleichzeitig eine der längsten Schlangen der Welt. Das Verbreitungsgebiet umfasst den tropischen Nordosten Australiens und ein paar vorgelagerte Inseln der Torres-Straße. Hier bewohnt er vordergründig dichten tropischen Regenwald, wo er etwa die Hälfte der Zeit auf Bäumen verbringt. Die Nahrung besteht aus einer Vielzahl unterschiedlicher Wirbeltiere, die der Größe des Pythons angepasst werden. Große Individuen erbeuten relativ häufig kleine Kängurus, die selten gegen 10 Kilogramm schwer sein können. Australische Amethystpythons sind wie alle Arten der Pythonidae eierlegend (ovipar) und gehören zu den Arten, bei denen die Weibchen die Bebrütungstemperatur durch Muskelzittern erhöhen können.
| Australischer Amethystpython | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
_Australia_Zoo.jpg.webp)
Australischer Amethystpython (Simalia kinghorni) | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Simalia kinghorni | ||||||||||||
| (Stull, 1933) |
Beschreibung
Körperbau
Der Australische Amethystpython ist ein schlanker, aber dennoch ziemlich kräftig gebauter Python. Sein langer Schwanz ist bei Männchen länger[1] ausgebildet und macht bei diesen bis über 15 %[2] der Gesamtlänge aus. Der große[1] Kopf ist deutlich vom Hals abgesetzt und bei adulten Weibchen deutlich verbreitert. Die Augen liegen an der Kopfseite und sind leicht nach vorne gerichtet. Die rundliche, von oben betrachtet, halbovale Schnauze ist bei Männchen länger ausgeprägt als bei Weibchen. Ihr sitzen die runden Nasenlöcher schräg zwischen Kopfoberseite und Kopfseite auf.[3]
Beschuppung
Das von oben nur mäßig sichtbare Rostrale (Schnauzenschild) hat, wie bei den meisten anderen Pythons auch, zwei tiefe Labialgruben.[4] Die Nasenlöcher sind jeweils im oberen hinteren Teil des großen Nasale (Nasenschild) positioniert. Vom Nasenloch bis zum Hinterrand des Schildes zieht eine gut erkennbare Naht. Zur Kopfmitte hin sind die Nasalia von einem Paar Internasalia (Zwischennasenschilden) separiert. Von der Schnauzenspitze her entlang der Mittellinie der Kopfoberseite folgen den Internasalia ein großes langes vorderes Paar Präfrontalia (Vorstirnschilde). Dieses hat meist großflächigen Kontakt zum dahinter liegenden einfachen großen Frontale (Stirnschild). Das hintere Paar Präfrontalia liegt den vorderen Präfrontalia seitlich an und wird durch dieses komplett getrennt.[5] Hinter dem Frontale schließen drei Paar große Parietalia (Scheitelschilde) an. Auf er Mittellinie zwischen diesen Schildpaaren können ein bis zwei kleine Interparietalia (Zwischenscheitelschilde) liegen.[4][5] Über den Augen befindet sich je ein großes dreieckiges Supraoculare (Überaugenschild). Präocularia (Voraugenschilde) existieren zwei bis drei, Postocularia (Hinteraugenschilde) drei bis fünf. Subocularia (Unteraugenschilder) fehlen bei dieser Art.[3] Auf der Seite des Kopfes zwischen Auge und Nasenloch liegen in ein bis drei Reihen angeordnet 7 bis 12 Lorealia (Zügelschilde).[3][4] Von den 12 bis 14 Supralabialia (Oberlippenschilde) tragen die vordersten vier an ihrem hinteren Rand tiefe Labialgrube, wobei die Labialgrubengröße gegen den Maulwinkel hin abnimmt.[4][5] Supralabialia Nummer 7 und 8 berühren zudem den Augenunterrand.[4] Infralabialia (Unterlippenschilde) gibt es 20 bis 24, wovon die vordersten zwei schwach erkennbare, und ab Nummer 10 bis 12 acht bis neun Unterlippenschilde tiefe Labialgruben tragen.[3][4][5] Die Kinngrube besteht aus schilderloser Haut oder selten auch wenigen kleinen Schilden.[5]
Die Anzahl der Ventralia (Bauchschilde) variiert zwischen 328 und 344, die Anzahl der dorsalen Schuppenreihen in der Körpermitte zwischen 51 und 55. Von der Kloake bis zur Schwanzspitze finden sich 108 bis 116 meist paarige[5] Subcaudalia (Schwanzunterseitenschilde).[4] Das Anale (Analschild) ist ungeteilt.[5]
Färbung

Vom Australischen Amethystpython sind keine ungemusterten oder axanthischen Farbmorphen bekannt.[3] Die Körpergrundfarbe ist hellbraun und wird auf dem Bauch zu weißgrau aufgehellt.[5] Entlang der Wirbelsäule verläuft eine breite, unregelmäßige, dunkelbraune bis schwarze Querbänderung und auf den Flanken je zwei unregelmäßige, teilweise unterbrochene dunkelbraune bis schwarze Längsbänder. Dabei gehen die Rückenbändern untereinander häufig Verbindungen ein und fusionieren zusätzlich oft mit den Längsbändern der Flanken.[4] Auf der hinteren Körperhälfte zum Schwanz hin werden die Rückenbänder meist länger und dehnen sich auf die Flanken aus, wodurch der Schwanz teilweise geringelt erscheint.[3]
Kopfoberseite und Kopfseite entsprechen der Körpergrundfarbe. Viele ihrer Schilde sind von einer feinen schwarzen Linie umrahmt. Lippen, Kinn und Kehle sind weißgrau. Ein dunkles Band zieht vom Augenhinterrand über den Oberrand der Oberlippenschilde bis zum Maulwinkel. Über den Hinterkopf verläuft von Maulwinkel zu Maulwinkel ein schwarzes Nackenband. Oft ist auch ein zweites, parallel dazu verlaufendes hinteres Nackenband oder ein simpler Nackenfleck vorhanden.[5] Die Iris ist bei diesem Amethystpython golden.[3]
Farbwechsel
Die Art zeigt einen gut ausgeprägten ontogenetischen Farbwechsel. Frisch geschlüpfte Jungtiere sind braun und besitzen eine matte Musterung. Sie werden jedoch bereits nach ihrer ersten Häutung rötlichbraun und ihr Muster kontrastreicher. Australische Amethystpythons sind des Weiteren befähigt unter Umwelteinflüssen ihre Farben über eine Periode von zirka 24 Stunden in geringem Maße zu intensivieren oder abzuschwächen. Auch während der kühlen Wintermonate und der Tragzeit werden Weibchen generell dunkler.[3]
Länge
Australische Amethystpythons zeigen bezüglich Länge und Masse einen starken Geschlechtsdimorphismus. Männchen erreichen die Geschlechtsreife bereits mit einer Kopf-Rumpf-Länge von zirka 1,34 Meter, Weibchen hingegen erst mit einer Kopf-Rumpf-Länge von etwa 2,27 Meter.[6] Im Gegensatz zu vielen anderen Pythons werden bei dieser Art die Männchen oft über einen Drittel länger und bis doppelt so schwerer wie Weibchen. Am Tully, einem Fluss zirka 140 Kilometer südlich von Cairns, wurden 24 adulte Weibchen vermessen. Diese hatten im Mittel eine Kopf-Rumpf-Länge von 2,68 Meter und eine Masse von 3,4 Kilogramm. Am selben Ort wurde an 80 adulte Männchen eine mittlere Kopf-Rumpf-Länge von 2,91 Meter und eine Masse von 5,1 Kilogramm ermittelt. Hiervon besaß das größte Männchen eine Kopf-Rumpf-Länge von 3,76 Meter und ein Gewicht von 11 Kilogramm.[1] Eine weitere Untersuchung einer geringeren Anzahl adulter Tiere auf den Atherton Tablelands lieferte sehr ähnliche Ergebnisse.[6]
In der Vergangenheit hatten wiederholt Längenangaben über 6 Meter langer Individuen Einzug in die Literatur, die heute allesamt nicht mehr nachprüfbar sind und unter anderem von Fearn & Sambono (2000) stark bezweifelt werden. Die extremsten Angaben stammen von Worell, der 1954 aus zweiter Hand von einem angeblich 8,5 Meter langen Tier aus Greenhill in Cairns berichtet, dieses 1958 noch als 7,6 Meter lang beschreibt und selbiges 1963 wiederholt unter der Erstlänge erwähnt. Dabei lässt er offen, ob sich die Masse auf einen Kadaver oder eine möglicherweise um mehr als 3 Meter gedehnte Haut beziehen. Auch Dean beschreibt 1954 ein extrem großes Individuum aus den Barron Falls mit einer Gesamtlänge von 7,2 Meter, das allerdings aus einem seit mehr als zwei Tagen in den Tropen verwesenden, künstlich in die Länge gezogenen Kadaver bestand. Das größte bis heute seriös vermessene Australische Amethystpythonweibchen wurde 2000 in Palm Cove bei Cairns gefangen, hatte eine Gesamtlänge von 5,65 Meter, wobei 12 Zentimeter auf den Kopf und 75 Zentimeter auf den Schwanz entfallen, einem Umfang in der Körpermitte von 36 Zentimeter und einer Masse von 24 Kilogramm.[7] Das größte bisher seriös vermessene Männchen wurde 2002 in Kuranda entdeckt, war gesamthaft 5,33 Meter lang, wovon der Kopf 11 Zentimeter und der unvollständige Schwanz 60 Zentimeter ausmachten und wog 17 Kilogramm.[8]
Verbreitung und Lebensraum
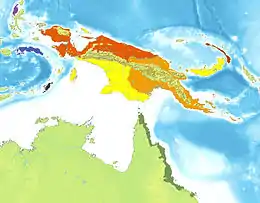
Sein Verbreitungsgebiet umfasst das tropische nordostaustralische Festland sowie mehrere Inseln der Torres-Straße vor der Kap-York-Halbinsel. Auf dem Festland erstreckt sich sein Vorkommen von der Spitze der Kap-York-Halbinsel südliche entlang des küstennahen Regenwaldes durch die Atherton Tablelands, die bewaldeten östlichen Gebirgsausläufer der Great Dividing Range, entlang der Küste über Mount Spec bis zum Burdekin River südlich von Townsville.[9] 2004 wurde zudem eine noch südlicher gelegene Population im Regenwald bei Conway, südlich von Airlie Beach, beschrieben.[10] Genaue Informationen über die Populationsgröße sowie allfällige Verbindungen zu nördlicheren Populationen liegen noch nicht vor. Sie steht allerdings unter Verdacht 1990 durch entwichene adulte Tiere aus einem dortigen Zoo begründet worden zu sein und sich seither erfolgreich auszubreiten.[9]
Der Australische Amethystpython lebt vordergründig in dichtem Primärem- und Sekundärem Regenwald. Daneben bewohnt er auch Buschwald, Eukalyptuswald[10] und Hartlaubvegetation. Gelegentlich wird er auch im hohen Gras von Waldlichtungen und Waldrändern angetroffen und dringt offenbar ab und zu auch auf Farmland und Farmen vor.[3][6][11]
Im südlichen Teil des Verbreitungsgebietes scheint die Art die 1000 Metergrenze nicht wesentlich zu überschreiten. Auf den Atherton Tablelands lebt er auf bis zu 900 Meter über Meer. Im kühleren südlichen Teil seiner Verbreitung scheint er meist nur in Wäldern mit Aufsitzerpflanzen (Epiphyten) vorzukommen.[6] Dabei bevorzugt er besonders Tüpfelfarngewächse der Art (Drynaria rigidula), weniger häufig auch Geweihfarne der Art Platycerium bifurcatum, Streifenfarne (Asplenium sp.) und Rattanpalmen der Gattung Calamus.[2] Diese auch auf Stämmen und Ästen oberhalb der dunklen Deckschicht des Waldes lebenden Pflanzen bilden ein günstiges Mikrohabitat gegen Klimaschwankungen. So können sich die Pythons untertags auf den Bäumen sonnen und müssen diese in der kühlen Nacht nicht extra verlassen.[6]
Verhalten

Über das Verhalten dieses Pythons ist bisher nur wenig bekannt. Er ist sowohl boden (terrestrisch)- als auch baumbewohnend (arboreal), wobei offenbar beinahe die Hälfte der Zeit auf Bäumen verbracht wird.[2] Die Art ist vordergründig tagaktiv und wärmen sich häufig vormittags aktiv an der Sonne, um tagsüber eine durchschnittliche Körpertemperatur von rund 25 °C aufrecht zu halten.[1] Auf den Atherton Tablelands nutzt dieser Python meist Aufsitzerpflanzen mit einem minimalen Umfang von einem Meter, in einer Höhe von 17 bis 40 Meter, als Sonnungs- und Versteckplatz. Andere Versteckmöglichkeiten über, in und unterhalb der Deckschicht des Waldes werden wesentlich seltener genutzt. Während die meisten Tiere offenbar immer wieder neue Aufsitzerpflanzen aufsuchen oder zwischen verschiedenen abwechseln, kann dieselbe selten auch über eine Periode von mindestens zwei Monaten beansprucht werden.[2]
Zumindest in südlichen Teilen des Verbreitungsgebietes wird das Wald-Habitat den Jahreszeiten entsprechend angepasst. Während der Trockenzeit werden bevorzugt Orte in Gewässernähe aufgesucht, zu Beginn der Regenzeit tauschen die Pythons dann überflutungsgefährdete Gebiete gegen trockene Areale.[1] In den kühlen Monaten erklimmen sie besonders oft hohe Bäume, um sich oberhalb der schattigen Waldvegetation zu sonnen.[2] Im Winter verlassen sie häufig sogar den dunklen, feuchten Regenwald um sich an sonnenexponierten Waldrändern zu wärmen. All diese Habitatswechsel spielen sich oft auf einem relativ fixen Territorium ab.[1] Von sechs teilweise mehr als zwei Jahre beobachteten adulten Australischen Amethystpythons, beanspruchte keiner ein Areal mit mehr als vier Kilometer Durchmesser.[2] Ein Peilsenderexperiment an einem Individuum mit 3,3 Meter Gesamtlänge hat zudem gezeigt, dass größere Tiere befähigt sind, täglich bis mindestens 348 Meter zurücklegen.[12]
Ernährung

Der Australische Amethystpython ist in Australien eines der größten einheimische bodenbewohnende Raubtiere. Sein Nahrungsspektrum besteht aus einer Vielzahl verschiedener Wirbeltiere, insbesondere aus Vögeln und Säugetieren.[1] Darunter beispielsweise Regenbogenspinte (Merops ornatus)[3], Buschratten (Rattus fuscipes)[1], Zwergbeutelmarder (Dasyurus hallucatus)[13], Brillenflughunde (Pteropus conspicillatus), Große Kurznasenbeutler (Isoodon macrourus)[1], Große Langnasenbeutler (Perameles nasuta) und Große Streifenbeutler (Dactylopsila trivirgata). Am Rande von Siedlungen ernährt sich die Art zudem immer wieder von Hausgeflügel.[12] Große Individuen fressen offenbar auch relativ häufig juvenile und semiadulte Vertreter wehrhafter kleiner Känguruarten, insbesondere solche von Flinkwallabys (Macropus agilis), Rotbeinfilander (Thylogale stigmatica) und Bennett-Baumkängurus (Dendrolagus bennettianus). Eines der größten bisher dokumentierten Beutetiere war ein 10 Kilogramm schweres adultes Flinkwallaby, das von einem gesamthaft 4,33 Meter langen und 13,5 Kilogramm schweren Pythonweibchen verschlungen wurde.[14]
Die Art bevorzugt die Lauerjagd, wozu sie teilweise bemerkenswert unterschiedliche Lauerpositionen einnimmt. In bewaldeten Arealen legt sich dieser Python entweder am Fuße von mit Beutetieren gut frequentierten Bäumen auf die Lauer, positioniert sich mit S-förmig angespanntem, vorschnellbereitem Vorderkörper auf einem horizontalen Ast in Bodennähe oder lässt sich im Geäst, einzig mit dem Schwanz befestigt, mitunter stundenlang mit S-förmig gespanntem Hals regungslos über einen Wildtierpfad hängen. In offeneren Gebieten am Rande von Wildtierpfaden, gelegentlich sogar am Rande gering befahrenen Straßen, verankern sich diese Pythons mit ihrem Schwanz oder teilweise dem gesamten Hinterkörper an einem fixen Gegenstand und passen dabei mit S-förmig angespanntem Vorderkörper den Pfad entlanglaufende Beutetiere ab. Auf Flächen mit hohem Gras rollen sich Australische Amethystpythons sogar eng oder lose zusammen und richten ihren Vorderkörper, einem Ast gleichend, vertikal bis zu 60 Zentimeter auf. Aus dieser Position können sie Beute besser ausmachen und sich frühzeitig nach ihr ausrichten.[13]
Fortpflanzung
%252C_hatchling.jpg.webp)
Über die Fortpflanzung im Freiland ist ebenfalls noch sehr wenig bekannt. Zumindest im Süden des Verbreitungsgebietes finden Balz und Paarung während der Regenzeit statt. Am Ufer des Tully, 140 Kilometer südlich von Cairns konnten kopulierende Paare bisher im Juni und Juli beobachtet werden.[1] Gefangenschaftsbeobachtungen zufolge liegen die Partner bei der teilweise 60 Minuten andauernden und manchmal wiederholt stattfindenden Paarung ausgestreckt nebeneinander, wobei nur ihre Schwänze in der Kloakenregion umeinander gewickelt sind.[15] Oft versammeln sich mehrere große Männchen um ein aufnahmefähiges Weibchen. Dabei wird gewöhnlich die Anwesenheit männlicher Konkurrenten geduldet, selten kommt es aber auch zu Kommentkämpfen, die über 30 Minuten[11] dauern können.[1] Hierzu richten zwei Rivalen ihren Vorderkörper bis zu einem Meter auf, schlingen sich umeinander und versuchen sich gegenseitig niederzuringen und zu beißen.[11] Die tiefen Bisswunden können insbesondere für kleinere Gegner gravierende Folgen haben, weshalb sie gewöhnlich solchen Ansammlungen fern bleiben. Die erhöhten Fortpflanzungschancen für große Männchen war vermutlich auch ein starker evolutionärer Selektionsgrund, weshalb die Art heute einen so ausgeprägten Geschlechtsdimorphismus zeigt.[1] Trächtige Weibchen nehmen zumindest in Gefangenschaft keine Nahrung zu sich und zeigen ein ausgeprägtes Sonnungsverhalten, wodurch die Entwicklung der Eier gefördert wird. Dabei liegen sie oft mit ihrem Bauch auf die Seite oder nach oben gedreht da.[11] Auch Freilandbeobachtungen zeigen, dass Weibchen sich in dieser Periode viel häufiger und ausgedehnter sonnen als Männchen.[1]
In Gefangenschaft werden 7 bis 20, im Schnitt 12 weißgraue Eier gelegt, die durchschnittlich 83 × 50 Millimeter messen und 100 Gramm schwer sind. Der zusammenklebende Eihaufen wird alsdann vom Weibchen umringt und beschützt. Durch aktives Muskelzittern ist das Weibchen zudem in der Lage eine konstante Inkubationstemperatur aufrecht zuhalten. Die in Gefangenschaft nach 78 bis 106 Tagen schlüpfenden Jungtiere haben eine durchschnittliche Gesamtlänge von 65 Zentimeter und besitzen ein Durchschnittsgewicht von 54 Gramm. Die hellbraun gefärbten und noch sehr matt gemusterten Jungschlangen häuten sich erstmals nach ein bis zwei Wochen.[3][11] In Gefangenschaft wachsen diese Pythons sehr schnell. Männchen erreichen die Geschlechtsreife hier bereits nach ihrem ersten Lebensjahr, während Weibchen dazu zirka zwei Jahre benötigen.[1]
Gefährdung
Anfang des 20. Jahrhunderts wurde der Regenwald in Nordost-Australien über Jahrzehnte großflächig gerodet um Ackerbau betreiben zu können. Hierdurch wurde auch zahlreiche Habitate des Australischen Amethystpythons isoliert, umstrukturiert und zerstört, was zum Populationsrückgang führte. 1988 wurde der noch übrig gebliebene Regenwald als Feuchttropen von Queensland zum UNESCO-Weltnaturerbe erklärt und seither nicht mehr gerodet. Obwohl die Population des Australischen Amethystpythons einst ein deutlich[2] größeres Verbreitungsgebiet hatte und eine höhere Dichte aufwies, sind die Bestände an gut geschützten Orten heute teilweise immer noch hoch. Früher wurden diese Pythons in der Nähe von Siedlungen oft getötet. Heute ist den meisten Einheimischen klar, dass diese Schlange weder giftig noch für den Menschen gefährlich ist und wird daher, im starken Kontrast zu Giftnattern, kaum noch getötet.[6]
Systematik
Der Amethystpython wurde 1801 von Schneider unter der wissenschaftlichen Bezeichnung Morelia amethistina erstbeschrieben. 1933 wies Stull der australischen Population als Morelia amethistina kinghorni Unterartstatus zu. Im Jahr 2000 differenzierten Harvey et al. unter Berücksichtigung von morphologischen, biogeographischen und molekulargenetischen Aspekten fünf eigenständige Arten: Morelia amethistina, Morelia kinghorni, Morelia nauta, Morelia clastolepis und Morelia tracyae. Alle bisher beschriebenen Amethystpythons bewohnen räumlich voneinander getrennte Lebensräume (Allopatrie). Es wird jedoch vermutet, dass unter den bisher beschriebenen Arten noch weitere Arten differenziert werden können, die teilweise sogar gleiche Gebiete bewohnen (Sympatrie). Hierzu besteht insbesondere auf Neuguinea und Neuirland starker Verdacht.
Es wird vermutet, dass einst eine Urform der Amethystpythons auf dem entstehenden Neuguinea gelebt hat. Vor Millionen von Jahren haben sich dann in einer ersten Phase die Inseln Halmahera und Neuirland durch tiefe Meeresengen von Neuguinea getrennt was die dortigen Amethystpython-Populationen komplett isolierte. Während späterer Eiszeiten bildeten sich durch den niedrigen Meeresspiegel Landbrücken zwischen Neuguinea und benachbarten Inseln sowie dem australischen Festland. So besiedelten Amethystpythons in einer zweiten Phase die D’Entrecasteaux-Inseln, den Louisiade-Archipel, Aru. Seram, Ambon, Yapen, küstennahe Inseln der Torres-Straße und Nordaustralien. Mittels Treibholz konnten diese Pythons dann in einer dritten Phase von Aru auf die benachbarte Insel Kai, und solche von Yapen auf die Nachbarinsel Biak gelangten. Auch die Tanimbar-Inseln hatten nie Kontakt zu anderen Landmassen, wodurch Vorläufer dieser Population ebenfalls über den Wasserweg die Inseln besiedelt haben müssen. Da sich Neuguinea geotektonisch ebenfalls noch stark veränderte, konnte sich die Urform des Amethystpythons auch hier noch lokal differenzieren.
Diese Pythons sind am nächsten mit dem Boelen-Python (Morelia boeleni) verwandt. Die charakteristische Gemeinsamkeit von Amethyst- und Boelen-Pythons ist das Vorhandensein von mindestens zwei Paaren großer Scheitelschilde. 1984 wurde von Wells & Wellington[16] vorgeschlagen, Amethystpythons von den Rautenpythons (Morelia) als eigenständige Gattung mit Namen Australiasis abzutrennen.
Der Gattungsname Australiasis ist allerdings ungültig, da die Gattung in einer Zeitschrift beschrieben wurde, die kein Peer-Review-Verfahren durchführt.[17] Anfang 2014 wurde deshalb der Gattungsname Simalia (Gray, 1849) für eine neue aus dem Boelen-Python, dem Oenpelli-Python und den Amethystpythons zusammengesetzte Gattung eingeführt.[18]
Die Verwandtschaftsverhältnisse stellen sich nach Harvey et al. (2000) und Reynolds et al. (2014) wie folgt dar:
| Simalia |
| ||||||||||||||||||||||||||||||||||||||||||||||||
Der Australische Amethystpython erhielt das Art-Epitheton kinghorni zu Ehren des australischen Herpetologen und Ornithologen James Roy Kinghorn seinen wissenschaftlichen Namen Simalia kinghorni.[4] Morphologisch unterscheidet sich der Australische Amethystpython teilweise nur wenig von der Neuguinea-Amethystpythonpopulation Südwest-Neuguineas. Auf genetischer Ebene zeigen die beiden Arten jedoch deutliche Differenzen und müssen sich folglich schon länger voneinander wegentwickelt haben. Unter den heute lebenden Amethystpythonarten sind sie nicht mal mehr am nächsten verwandt.[3]
Literatur
- M. B. Harvey, D. G. Barker, L. K. Ammerman, P. T. Chippindale: Systematics of Pythons of the Morelia amethistina Complex (Serpentes: Boidae) with the Description of three new Species. Herpetological Monographs 14, 2000, S. 139–185.
Weblinks
Einzelnachweise
- S. Fearn, L. Schwarzkopf, R. Shine: Giant snakes in tropical forests: a field study of the Australian scrub python, Morelia kinghorni. Wildlife Research 32, 2005, S. 1–9. doi:10.1071/WR04084
- A. Freeman, A. Freeman: Habitat Use in a Large Rainforst Python (Morelia kinghorni) in the Wet Tropics of North Queensland, Australia. Herpetological Conservation and Biology 4, Heft 2, 2009, S. 252–260, online, pdf
- M. B. Harvey, D. G. Barker, L. K. Ammerman, P. T. Chippindale: Systematics of Pythons of the Morelia amethistina Complex (Serpentes: Boidae) with the Description of three new Species. Herpetological Monographs 14, 2000, S. 139–185.
- O. G. Stull: Two new subspecies of the family Boidae. Occasional Papers of the Museum of Zoology, University of Michigan 267, 1933, S. 1–4, online, pdf
- S. B. McDowell: A catalogue of the snakes of New Guinea an the Solomons, with spezial reference to those in the Bernice P. Bishop Museum. Part II. Anilioidea and Pythoninae. Journal of Herpetology 9, 1975, S. 1–79.(Anhand der beschriebenen Lokalitäten, wurden so weit wie möglich artspezifische Daten entnommen, die auf die heutige Morelia kinghorni zutreffen)
- A. Freeman, C. Bruce: The Things You Find on the Road: Roadkill and Incidental Data as an Indicator of Habitat Use in Two Species of Tropical Pythons. In: R. W. Henderson, R. Powell (Hrsg.): Biology of the Boas and Pythons. Eagle Mountain Publishing Company, Eagle Mountain 2007, ISBN 978-0-9720154-3-1, S. 153–165.
- S. L. Fearn, J. Sambono: A reliable size record for the Scrub Python Morelia amethistina (Serpentes: Pythonidae) in north east Queensland. Herpetofauna 30, 2000, S. 2–6.
- S. L. Fearn: Notes on a maximal sized Scrub Python Morelia amethistina (Serpentes: Pythonidae) from Kuranda, North East Queensland. Herpetofauna 32, 2002, S. 2–3.
- S. L. Fearn, D. Trembath: Southern distribution limits and a traslocated population of scrub python Morelia kinghorni (Serpentes: Pythonidae) in tropical Queensland. Herpetofauna 36, Heft 2, 2006, S. 85–87.
- J. Augusteyn: Southerly range extension for the amethystine python Morelia kinghorni (Squamata: Boidae) in Queensland. Memoirs of the Queensland Museum 49, Heft 2, 2004, S. 602, online, pdf
- L. Sues, R. Shine: Morelia amethistina (Australian Scrub Python). Male-Male Combat. Herpetological Review 30, Heft 2, 1999, S. 102.
- R. W. Martin: Field Observation of Predation on Bennett's Treekangaroo (Dendrolagus bennettianus) by an Amethystine Python (Morelia amethistina). Herpetological Review 26, Heft 2, 1995, S. 74–76
- S. L. Fearn, J. Sambono: Some ambush predation postures of the Scrub Python Morelia amethistina (Serpentes: Pythonidae) in north east Queensland. Herpetofauna 30, 2000, S. 39–44.
- S. Fearn: Morelia amethistina (Scrub Python). Diet. Herpetological Review 33, Heft 1, 2002, S. 58–59
- N. Charles, R. Field, R. Shine: Notes on the Reproductive Biology of Australian Pythons, Genera Aspidites, Liasis and Morelia. Herp Review 16, Heft 2, 1985, S. 45–48, online, pdf
- R. W. Wells, C. R. Wellington: A classification of the Amphibia and Reptilia of Australia. Australian Journal of Herpetology, Supplementary Series, Heft 1, 1984 S. 1–61, Volltext (Seite nicht mehr abrufbar, Suche in Webarchiven) Info: Der Link wurde automatisch als defekt markiert. Bitte prüfe den Link gemäß Anleitung und entferne dann diesen Hinweis.
- Hinrich Kaiser, Brian I. Crother, Christopher M. R. Kelly, Luca Luiselli, Mark O´Shea, Hidetoshi Ota, Paulo Passos, Wulf D. Schleip, Wolfgang Wüster: Best Practices: In the 21st Century, Taxonomic Decisions in Herpetology are Acceptable Only When Supported by a Body of Evidence and Published via Peer-Review. In: Herpetological Review, 2013, 44(1), 8–23.. 44, 2013, S. 8–23.
- R. Graham Reynolds, Matthew L. Niemiller, Liam J. Revell: Toward a Tree-of-Life for the boas and pythons: Multilocus species-level phylogeny with unprecedented taxon sampling. Molecular Phylogenetics and Evolution, Volume 71, February 2014, Pages 201–213, doi: 10.1016/j.ympev.2013.11.011