Asymmetrische Dihydroxylierung
Die Asymmetrische Dihydroxylierung (im Englischen oft abgekürzt als SAD für Sharpless Asymmetric Dihydroxylation[1]) ist eine von Barry Sharpless entwickelte katalytische asymmetrische Oxidation eines Olefins zu einem cis-vicinalen Diol. Die hohe Enantioselektivität der Reaktion kommt durch den Einsatz eines chiralen Liganden zustande.
Reagenzien
2PHAL.svg.png.webp)
2PHAL.svg.png.webp)
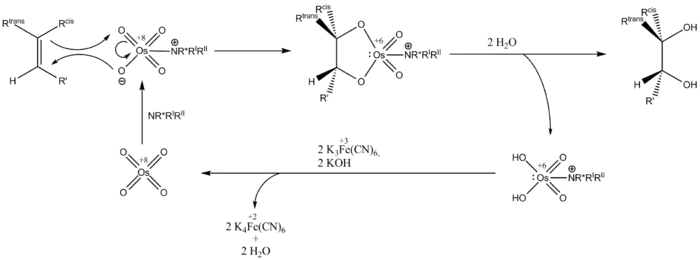
Die Reaktion wird mit einer katalytischen Menge Osmium(VIII)-oxid durchgeführt, das meistens als ein Os(VI)-Salz zugegeben wird und im Reaktionsverlauf von einem Kooxidans – K3Fe(CN)6[2] oder auch NMO – zur Os(VIII)-Spezies oxidiert wird.
Als chirale Liganden werden oft Dihydrochinin- oder Dihydrochinidinderivate[3] zugesetzt, was im Handel als AD-Mix angeboten wird. AD-Mix α enthält neben K2OsO2(OH)4, K3Fe(CN)6 und K2CO3 den Liganden (DHQ)2PHAL in katalytischer Menge, während AD-Mix β als Liganden (DHQD)2PHAL enthält. Als Lösungsmittel wird ein Zwei-Phasen-Gemisch – beispielsweise tert-Butanol und Wasser – verwendet, um eine vorzeitige Reoxidation des cyclischen Osmats und den damit einhergehenden Verlust der Enantioselektivität zu verhindern. Zudem wird oft Methansulfonamid eingesetzt, das die Hydrolyse beschleunigt und als Phasentransferkatalysator fungiert.[4]
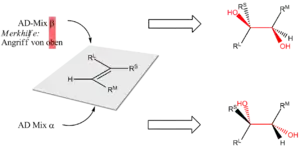
Das Osmium(VIII)oxid wird über ein freies Elektronenpaar im sp3-Atomorbital des Stickstoffs eines Dihydrochinidins (siehe Grafik) gebunden, was eine Ligandenbeschleunigung zur Folge hat und die gesamte Reaktion über den Reaktionspfad des chiralen Komplexes ablaufen lässt. Dies wiederum hat die hohe Enantioselektivität zur Folge. Aufgrund der durch die Konformation des Liganden und des daran gebundenen Osmium(VIII)-oxids wird eine „chirale Tasche“ gebildet, ähnlich dem aktiven Zentrum eines Enzyms, in der sich das Olefin nur in einer bestimmten Konformation orientiert.[5][6]
Reaktionsmechanismus
Aus dem Olefin und dem Osmium(VIII)-oxid-Ligand-Komplex geht durch eine [3+2]-Cycloaddition ein fünfgliedriges cyclisches Intermediat hervor, das hydrolysiert und das Diol freisetzt. Zudem entsteht das reduzierte Osmat, welches von dem überstöchiometrisch zugesetzten Kooxidans reoxidiert wird.
Siehe auch
Andere Reaktionen von Barry Sharpless
Einzelnachweise
- Laszlo Kurti, Barbara Czako: Strategic Applications of Named Reactions in Organic Synthesis: Background and Detailed Mechanisms. Elsevier Academic Press, ISBN 978-0-12-429785-2, S. 406.
- Makoto Minato, Keiji Yamamoto und Jiro Tsuji: Osmium Tetraoxide Catalyzed Vicinal Hydroxylation of Higher Olefins by Using Hexacyanoferrate(III) Ion as a Cooxidant. In: The Journal of Organic Chemistry. Band 55, Nr. 2, 1990, S. 766–768, doi:10.1021/jo00289a066.
- Philippe Dupau, Robert Epple, Allen A. Thomas, Valery V. Fokin und K. Barry Sharpless: Osmium-Catalyzed Dihydroxylation of Olefins in Acidic Media: Old Process, New Tricks. In: Advanced Synthesis & Catalysis. Band 344, Nr. 3–4, Juni 2002, S. 421–433, ISSN 1615-4150, doi:10.1002/1615-4169(200206)344:3/4<421::AID-ADSC421>3.0.CO;2-F.
- Mikko H. Junttila und Osmo O. E. Hormi: Methanesulfonamide: A Cosolvent and a General Acid Catalyst in Sharpless Asymmetric Dihydroxylations. In: The Journal of Organic Chemistry. Band 74, Nr. 8, 2009, S. 3038–3047, doi:10.1021/jo8026998.
- E. J. Corey, Mark C. Noe und Sepehr Sarshar: X-Ray Crystallographic Studies Provide Additional Evidence that an Enzyme-Like Binding Pocket is Crucial to the Enantioselective Dihydroxylation of Olefins by OsO4—bis-cinchona Alkaloid Complexes. In: Tetrahedron Letters. Band 35, Nr. 18, 2. Mai 1994, S. 2861–2864, doi:10.1016/S0040-4039(00)76644-5.
- Hartmuth C. Kolb, Pher G. Andersson und K. Barry Sharpless: Toward an Understanding of the High Enantioselectivity in the Osmium-Catalyzed Asymmetric Dihydroxylation (AD). 1. Kinetics. In: Journal of the American Chemical Society. Band 116, Nr. 4, 1994, S. 1278–1291, doi:10.1021/ja00083a014.
Literatur
- Hartmuth C. Kolb, Michael S. Van Nieuwenhze und K. Barry Sharpless: Catalytic Asymmetric Dihydroxylation. In: Chemical Reviews. Band 94, Nr. 8, 1994, S. 2483–2547, doi:10.1021/cr00032a009.
- Reinhard Brückner: Reaktionsmechanismen. Organische Reaktionen, Stereochemie, moderne Synthesemethoden. 2. Auflage, Spektrum Akademischer Verlag, Heidelberg und Berlin 2003, ISBN 3-8274-1189-0, S. 753–758.
- Jie Jack Li und E. J. Corey: Name Reactions of Functional Group Transformations. Wiley Interscience, New York 2007, ISBN 978-0-471-74868-7, S. 67–83.