Sharpless-Aminohydroxylierung
Die Sharpless-Aminohydroxylierung (oft abgekürzt als AA für asymmetrische Aminohydroxylierung,[1] im Englischen auch als Oxyamination bezeichnet[2][3]) ist eine Namensreaktion der Organischen Chemie.[4] Sie ist nach dem Chemie Nobelpreisträger Barry Sharpless benannt, welcher 1976 erste Hinweise auf sie fand.[2] Sharpless berichtete allerdings erst 1996 von einer enantioselektiven Variante.[5][6] Mithilfe dieser Reaktion können Olefine in einer cis-vic-Aminohydroxylierung in β-Aminoalkohole überführt werden.[7] Die Reaktion ist eng verwandt mit der asymmetrischen Dihydroxylierung und kann als dessen Aza-Analoga betrachtet werden.[8] Die Reaktion ist durch eine hohe Enantioselektivität gekennzeichnet und wird oft als Eintopfreaktion geführt. Die asymmetrische Aminohydroxylierung ist von Bedeutung, da die dabei erhaltenen β-Aminoalkohole für biologische Systeme von großer Relevanz sind.[6][9] Die Reaktion ist ebenso von großem Interesse für die Totalsynthese.[6]
Die asymmetrische Aminohydroxylierung ist nach der asymmetrischen Epoxidierung und der asymmetrischen Dihydroxylierung eine der bekanntesten Reaktionen von Sharpless.[10] Allgemein gilt die asymmetrische Aminohydroxylierung allerdings als noch nicht vollständig ausgereift, da die Kontrolle der Regioselektivität nach wie vor eine Herausforderung darstellt.[6][11][12][13] Die Regioselektivität wird nicht allein durch die verwendeten Liganden des Katalysatorsystems, sondern durch viele Faktoren beeinflusst.[7]
Übersicht
In der Sharpless-Aminohydroxylierung werden Olefine in einem Katalysatorsystem mithilfe einer Osmium(VI)-Spezies, einer Stickstoffquelle und einem Liganden zu β-Aminoalkoholen überführt.[7] Als Stickstoffquelle verwendet man Alkalimetallsalze N-halogenierter Sulfonamide, N-halogenierter Alkylcarbamate oder N-halogenierten Amiden.[8] Als Osmium(VI)-Spezies wird Kaliumosmat(VI)-Dihydrat K2OsO4 · 2 H2O (andere Schreibweise: K2Os2(OH)4) verwendet.[8] Als Lösungsmittel kommen meistens Gemische aus Alkoholen und Wasser zum Einsatz.[6] Bei der Sharpless-Aminohydroxylierung werden analog zur Sharpless-Dihydroxylierung dimere Liganden auf Basis von Chinona-Alkaloiden verwendet, meistens (DHQ)2PHAL oder (DHQD)2PHAL.[6]
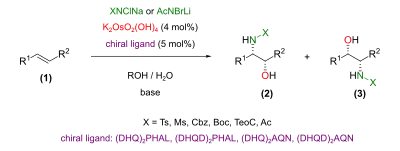 Allgemeines Reaktionsschema einer asymmetrischen Aminohydroxylierung nach Sharpless: Ein Olefin (1) wird mit einer Stickstoffquelle und einem Osmium-Katalysatorsystem zu den Regioisomeren β-Aminoalkoholen (2) und (3) umgesetzt.
Allgemeines Reaktionsschema einer asymmetrischen Aminohydroxylierung nach Sharpless: Ein Olefin (1) wird mit einer Stickstoffquelle und einem Osmium-Katalysatorsystem zu den Regioisomeren β-Aminoalkoholen (2) und (3) umgesetzt.2PHAL.svg.png.webp) (DHQ)2PHAL
(DHQ)2PHAL2PHAL.svg.png.webp) (DHQD)2PHAL
(DHQD)2PHAL
Mechanismus
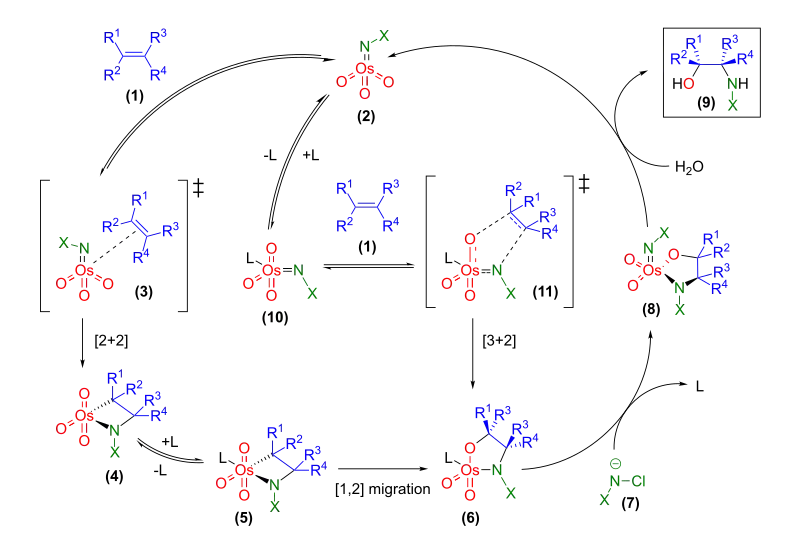
Die asymmetrische Aminohydroxylierung ist mechanistisch eng verwandt mit der asymmetrischen Dihydroxylierung.[7] Zunächst kommt es zur Bildung eines Osmium(VI) azaglycolats (6). Ausgehend von der Imidotrioxoosmium(VI)spezies (2) kann dies entweder über eine schrittweise [2+2] Cycloaddition oder eine [3+2] Cycloaddition erfolgen. Die Cycloaddition erfolgt in beiden Fällen syn-stereospezifisch. Sharpless schlug ursprünglich vor,[14] dass die [2+2] Cycloaddition des Olefins zu einem Osmaazetidin (4) führt, welches sich nach Koordination eines weiteren Liganden und einer [1,2]-Migration des Intermediats (5) zu (6) umwandelt.[15][7] Theoretische Untersuchungen von Sharpless und Kendal Houk aus 1997 stellen dies jedoch in Frage. Demnach gibt es Hinweise, dass die [3+2] Cycloaddition der geschwindigkeitsbestimmende Schritt für die Bildung von (6) ist.[16] Auch theoretische Berechnungen von Gernot Frenking aus 1996 deuten darauf hin, dass eine [2+2] Cycloaddition unwahrscheinlich ist.[17] Das Intermediat (6) wird nach der Addition von (7) zum enantiomerenreinen β-Aminoalkohol (9) hydrolysiert, wobei (2) regeneriert wird. 1996 schlug Sharpless vor, dass auch eine sekundärer Katalysezyklus möglich ist, wenn ein weiteres Äquivalent des Olefins an (8) addiert (dieser ist in der nachfolgenden Abbildung der Übersichtlichkeit wegen nicht dargestellt).[18][4]
Beispiele
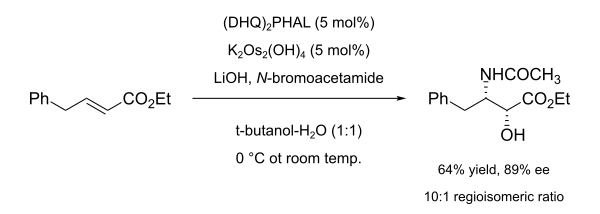
Zur Synthese eines HIV-Proteaseinhibitors verwendeten Kondekar et al. 2004 die asymmetrische Aminohydroxylierung im folgenden Schritt:[19]
Siehe auch
Andere bedeutende Reaktionen von Barry Sharpless:
Literatur
- László Kürti, Barbara Czakó: Strategic Applications of Named Reactions in Organic Synthesis: Background and Detailed Mechanisms, Elsevier, ISBN 978-0124297852, S. 404, 673.
- Reinhard Brückner: Reaktionsmechanismen: organische Reaktionen, Stereochemie, moderne Synthesemethoden. 3. Aufl., aktualisiert und überarb., korr. Nachdr. Spektrum Akad. Verl, Berlin 2007, ISBN 3-8274-1579-9, S. 755–757.
- Erick M. Carreira: Classics in stereoselective synthesis. Wiley-VCH, Weinheim [Germany] 2009, ISBN 978-3-527-32452-1, S. 300–302.
- Michael B. Smith: March's Advanced Organic Chemistry: Reactions, Mechanisms, and Structure. Hrsg.: Wiley-VCH. 8. Auflage. John Wiley & Sons, Hoboken, New Jersey 2020, ISBN 978-1-119-37180-9, S. 1019–1020.
Weblinks
Einzelnachweise
- Peter O'Brien: Möglichkeiten und Grenzen der asymmetrischen Sharpless-Aminohydroxylierung in der organischen Synthese. In: Angewandte Chemie. Band 111, Nr. 3, 1999, ISSN 1521-3757, S. 339–342, doi:10.1002/(SICI)1521-3757(19990201)111:3<339::AID-ANGE339>3.0.CO;2-E (wiley.com [abgerufen am 27. Januar 2022]).
- K. Barry Sharpless, Donald W. Patrick, Larry K. Truesdale, Scott A. Biller: New reaction. Stereospecific vicinal oxyamination of olefins by alkyl imido osmium compounds. In: Journal of the American Chemical Society. Band 97, Nr. 8, April 1975, ISSN 0002-7863, S. 2305–2307, doi:10.1021/ja00841a071 (acs.org [PDF; abgerufen am 11. Februar 2022]).
- Michael B. Smith: March's Advanced Organic Chemistry: Reactions, Mechanisms, and Structure. Hrsg.: Wiley-VCH. 8. Auflage. John Wiley & Sons, Hoboken, New Jersey 2020, ISBN 978-1-119-37180-9, S. 1019–1020.
- Dmitry Nilov, Oliver Reiser: The Sharpless Asymmetric Aminohydroxylation –Scope and Limitation. In: Advanced Synthesis & Catalysis. Band 344, Nr. 10, 2002, ISSN 1615-4169, S. 1169–1173, doi:10.1002/1615-4169(200212)344:10<1169::AID-ADSC1169>3.0.CO;2-G (wiley.com [abgerufen am 27. Januar 2022]).
- Guigen Li, Han-Ting Chang, K. Barry Sharpless: Catalytic Asymmetric Aminohydroxylation (AA) of Olefins. In: Angewandte Chemie International Edition in English. Band 35, Nr. 4, 1996, ISSN 1521-3773, S. 451–454, doi:10.1002/anie.199604511 (wiley.com [abgerufen am 27. Januar 2022]).
- Erick Moran Carreira: Classics in stereoselective synthesis. Wiley-VCH, Weinheim [Germany] 2009, ISBN 978-3-527-32452-1, S. 300–302.
- László Kürti: Strategic applications of named reactions in organic synthesis : background and detailed mechanisms. Elsevier Academic Press, Amsterdam 2005, ISBN 978-0-12-429785-2.
- Reinhard Brückner: Reaktionsmechanismen: organische Reaktionen, Stereochemie, moderne Synthesemethoden. 3. Aufl., aktualisiert und überarb., korr. Nachdr. Spektrum Akad. Verl, Berlin 2007, ISBN 3-8274-1579-9, S. 755–757.
- Joachim Rudolph, Peter C. Sennhenn, Cornelis P. Vlaar, K. Barry Sharpless: Smaller Substituents on Nitrogen Facilitate the Osmium-Catalyzed Asymmetric Aminohydroxylation. In: Angewandte Chemie International Edition in English. Band 35, Nr. 2324, Dezember 1996, ISSN 0570-0833, S. 2810–2813, doi:10.1002/anie.199628101 (wiley.com [abgerufen am 13. Februar 2022]).
- Jonathan Clayden: Organische Chemie. 2. Auflage. Berlin 2013, ISBN 978-3-642-34715-3.
- Iwao Ojima: Catalytic asymmetric synthesis. 2nd ed Auflage. Wiley-VCH, New York 2000, ISBN 0-471-29805-0, S. 399–428.
- Jennifer A. Bodkin, Malcolm D. McLeod: The Sharpless asymmetric aminohydroxylation. In: Journal of the Chemical Society, Perkin Transactions 1. Nr. 24, 19. Dezember 2002, ISSN 1364-5463, S. 2733–2746, doi:10.1039/B111276G (rsc.org [abgerufen am 11. Februar 2022]).
- Carlo Bonini, Giuliana Righi: A critical outlook and comparison of enantioselective oxidation methodologies of olefins. In: Tetrahedron. Band 58, Nr. 25, Juni 2002, S. 4981–5021, doi:10.1016/S0040-4020(02)00440-4 (elsevier.com [abgerufen am 11. Februar 2022]).
- K. B. Sharpless, A. O. Chong, Koichiro Oshima: Osmium-catalyzed vicinal oxyamination of olefins by Chloramine-T. In: The Journal of Organic Chemistry. Band 41, Nr. 1, Januar 1976, ISSN 0022-3263, S. 177–179, doi:10.1021/jo00863a052 (acs.org [abgerufen am 13. Februar 2022]).
- Majid M. Heravi, Tahmineh Baie Lashaki, Bahareh Fattahi, Vahideh Zadsirjan: Application of asymmetric Sharpless aminohydroxylation in total synthesis of natural products and some synthetic complex bio-active molecules. In: RSC Advances. Band 8, Nr. 12, 2018, ISSN 2046-2069, S. 6634–6659, doi:10.1039/C7RA12625E (rsc.org [abgerufen am 13. Februar 2022]).
- Albert J. DelMonte, Jan Haller, K. N. Houk, K. Barry Sharpless, Daniel A. Singleton: Experimental and Theoretical Kinetic Isotope Effects for Asymmetric Dihydroxylation. Evidence Supporting a Rate-Limiting “(3 + 2)” Cycloaddition. In: Journal of the American Chemical Society. Band 119, Nr. 41, 1. Oktober 1997, ISSN 0002-7863, S. 9907–9908, doi:10.1021/ja971650e (acs.org [abgerufen am 13. Februar 2022]).
- Ulrich Pidun, Christian Boehme, Gernot Frenking: Theory Rules Out a[2+ 2] Addition of Osmium Tetroxide to Olefins as Initial Step of the Dihydroxylation Reaction. In: Angewandte Chemie International Edition in English. Band 35, Nr. 2324, Dezember 1996, ISSN 0570-0833, S. 2817–2820, doi:10.1002/anie.199628171 (wiley.com [abgerufen am 13. Februar 2022]).
- Joachim Rudolph, Peter C. Sennhenn, Cornelis P. Vlaar, K. Barry Sharpless: Smaller Substituents on Nitrogen Facilitate the Osmium-Catalyzed Asymmetric Aminohydroxylation. In: Angewandte Chemie International Edition in English. Band 35, Nr. 2324, Dezember 1996, ISSN 0570-0833, S. 2810–2813, doi:10.1002/anie.199628101 (wiley.com [abgerufen am 13. Februar 2022]).
- Nagendra B Kondekar, Subba Rao V Kandula, Pradeep Kumar: Application of the asymmetric aminohydroxylation reaction for the syntheses of HIV-protease inhibitor, hydroxyethylene dipeptide isostere and γ-amino acid derivative. In: Tetrahedron Letters. Band 45, Nr. 28, Juli 2004, S. 5477–5479, doi:10.1016/j.tetlet.2004.05.057 (elsevier.com [abgerufen am 11. Februar 2022]).