Alkalische Brennstoffzelle
Die Alkalische Brennstoffzelle (engl. Alkaline Fuel Cell, AFC) ist eine Niedrigtemperatur-Brennstoffzelle mit einer konzentrierten wässrigen Lauge als Elektrolyt. Alkalische Brennstoffzellen waren ein bedeutender Schritt in der Entwicklung der Brennstoffzellentechnik. Sie haben in der Raumfahrt eine wichtige Rolle gespielt, vor allem im Apollo-Programm und im Space Shuttle. Heute sind sie im Vergleich zur Polymerelektrolytzelle nur noch von geringer Bedeutung, und nur noch wenige Firmen – darunter das in der englischen Grafschaft Surrey beheimatete Unternehmen AFC Energy[1] – entwickeln sie weiter.
Der mit Abstand wichtigste Energielieferant („Brennstoff“) für die alkalische Brennstoffzelle ist Wasserstoff. Alternativ dazu können stattdessen auch Ammoniak (siehe Ammoniak-Brennstoffzelle) oder Hydrazin (Hydrazin-Brennstoffzelle) als Energielieferanten verwendet werden.
Prinzip
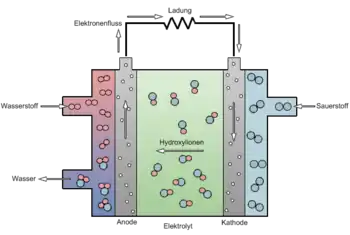
In der Regel wird eine wässrige Kaliumhydroxid-Lösung als Elektrolyt verwendet. Da diese Lauge stark alkalisch ist – sie hat einen hohen pH-Wert – wird die Zelle als alkalische Brennstoffzelle bezeichnet. Der zumeist als „Brenngas“ dienende Wasserstoff wird der Anode zugeführt und dort zu H+ oxidiert. Zusammen mit OH−-Ionen, die an der Kathode durch Reduktion von Sauerstoff gebildet werden, und über den Elektrolyten zur Anode gelangen, bildet sich an der Anode das Reaktionsprodukt Wasser, welches ständig abgeführt werden muss. Die Arbeitstemperatur der Zelle liegt bei 60–120 °C (oder bei 200–230 °C bei den Apollo-Zellen[2]).
Die der Kathode zugeführte Luft sollte frei von CO2 sein, da CO2 nach
Kaliumcarbonat ausfällt. Das feste Carbonat kann z. B. durch Verstopfung von porösen Elektroden zu einem Leistungsabfall der Zelle führen. Nach einer Studie gilt das aber nicht für alle Zelltypen, in dem untersuchten Fall war die Alterung der Zellen unabhängig vom CO2-Gehalt des verwendeten Sauerstoffs.[3][4]
Im Vergleich zur PEMFC hat die AFC eine geringere Leistungsdichte, aber aufgrund der höheren Zellenspannung einen etwas besseren Wirkungsgrad. Sie erreicht jedoch zurzeit nicht die hohen Stromdichten einer PEMFC. Der Elektrolyt dient gleichzeitig zur Temperaturregelung des Stacks, womit kein weiterer Kühlkreislauf notwendig ist.
Entwicklung der Zelle und ihre Anwendungsbereiche
Die Erfindung der alkalischen Brennstoffzellen wird aufgrund entsprechender Patente einem amerikanischen[5][6][7] und einem französischen[8] Erfinder zugeschrieben.[3] Der herausragende Pionier der Entwicklung von alkalischen Brennstoffzellen – durch die auch die Entwicklung der Brennstoffzellen insgesamt vorangetrieben wurde – war aber der englische Ingenieur Francis Thomas Bacon (1904–1992). Er brachte die Brennstoffzelle in England bis zur Anwendungsreife. Vor allem amerikanische Unternehmen, z. B. Allis-Chalmers und Pratt & Whitney, setzten dann die weitere Entwicklung fort; daneben arbeiteten andere, z. B. in Deutschland Eduard Justi, an der AFC. Die Anwendungsreife wurde zunächst in Demonstrationsprojekten wie dem Allis-Chalmers-Brennstoffzellentraktor vorgeführt. Danach wurde die AFC in der bemannten Raumfahrt eingesetzt: Bei den Apollo-Raumschiffen wurden AFCs von Pratt & Whitney verwendet,[2] die eine Nennleistung von 1,12 kW (Maximum: 2,3 kW[9]) bei einer Spannung von 28 V lieferten und an neun Mondflügen teilnahmen.[2] Auch das Skylab, das Raumschiff LOK und das Space Shuttle nutzte AFCs. Siemens installierte AFCs in U-Booten, wandte sich dann aber schließlich der PEMFC zu. 1998 fuhr in London der Prototyp eines Taxis mit alkalischer Brennstoffzelle,[10] und das Unternehmen stattete auch einen Lieferwagen mit der AFC aus.[11] Dieser Zelltyp wurde auch für den Antrieb des Elektromotors im Passagierboot Hydra (2000 bis 2001 in Dienst) genutzt. Im Jahr 2002 mussten diese Entwicklungen aus Geldmangel beendet werden.[11]
Reaktionsgleichungen
| Gleichung | |
|---|---|
| Anode | Oxidation / Elektronenabgabe |
| Kathode | Reduktion / Elektronenaufnahme |
| Gesamtreaktion | Redoxreaktion / Zellreaktion |
Der innere Ladungstransport erfolgt mittels Hydroxidionen. Auf der Kathodenseite benötigt die Reaktion nur reinen Sauerstoff und produziert Wasser auf der Anodenseite, auf der nur reiner Wasserstoff benötigt wird.
Vor- und Nachteile gegenüber anderen Brennstoffzellen
Vorteile einer AFC sind:
- robustes System
- gutes dynamisches Verhalten
- preiswerte Katalysatoren (Nickel, Silber)
- tolerant gegenüber Spuren von Ammoniak[12]
Nachteile sind:
- möglicherweise empfindlich gegen Verschmutzungen, insbesondere durch CO2 (möglicherweise auch nicht)
- niedrige Lebensdauer, bedingt durch den korrosiven Elektrolyten
Ein gutes Potential zur Weiterentwicklung haben alkalische Brennstoffzellen. Forschungen beschäftigen sich insbesondere mit unterschiedlichen Materialien für Membranen und Elektroden. Als besonders wirkungsvoll haben sich hierbei Elektroden mit Goldkatalysator erwiesen.[13]
Einzelnachweise
- AFC Energy PLC – Producer of alkaline fuel cell systems. Abgerufen am 18. Juni 2019 (amerikanisches Englisch).
- Peter Kurzweil: Brennstoffzellentechnik. Grundlagen, Komponenten, Systeme, Anwendungen. 2., überarbeitete und aktualisierte Auflage. Springer Vieweg, Wiesbaden 2013, ISBN 978-3-658-00085-1, S. 65–66, doi:10.1007/978-3-658-00085-1.
- Erich Gülzow: Alkaline fuel cells: a critical view. In: Journal of Power Sources. Band 61, Nr. 1-2. Elsevier, Juli 1996, ISSN 0378-7753, S. 99–104, doi:10.1016/S0378-7753(96)02344-0 (elsevier.com).
- Erich Gülzow, Jiri K. Nor, Peter K. Nor, Mathias Schulze: A renaissance for alkaline fuel cells. In: The Fuel Cell Review. Band 3, Nr. 1. Institute of Physics Publishing, Februar 2005, S. 19–25.
- Patent US0736016: Process of Generating Electricity. Angemeldet am 17. Mai 1902, veröffentlicht am 11. August 1903, Erfinder: James H. Reid (US).
- Patent US0736017: Gas Battery. Angemeldet am 20. Dezember 1902, veröffentlicht am 11. August 1903, Erfinder: James H. Reid (US).
- Patent US0757637: Gas Battery. Angemeldet am 3. August 1903, veröffentlicht am 19. April 1904, Erfinder: James H. Reid (US).
- Patent FR350100: Générateur électrique à gaz. Angemeldet am 4. August 1904, veröffentlicht am 13. Oktober 1905, Erfinder: Paul Gustave Leon Noel.
- Fuel Cell, Apollo. 11. März 2016, abgerufen am 18. Juni 2019 (englisch).
- Collecting the History of Alkali Fuel Cells. In: Fuel Cell History Project. National Museum of American History, Smithsonian Institution, 2009, abgerufen am 20. Juni 2019 (englisch, Die Zero Emission Vehicle Company (ZEVCO) wurde 2001 in ZeTek Power umbenannt.).
- Alkalische Brennstoffzelle – AFC. In: Fuel Cells – Electrochemical Power > Brennstoffzellentypen. Fuel Cell Norway ANS, 2006, abgerufen am 20. Juni 2019.
- Florian Ernst Nigbur: Ammoniak-Cracker zur Brenngasversorgung von Brennstoffzellen - Experimentelle und simulative Untersuchungen. 1. Auflage. Cuvillier-Verlag, Göttingen 2021, ISBN 978-3-7369-7497-5.
- Paola Quaino, Noelia B. Luque, Renat Nazmutdinov, Elizabeth Santos, Wolfgang Schmickler: Warum ist Gold in alkalischer Lösung so ein guter Katalysator für die Sauerstoffreduktion? In: Angewandte Chemie. Band 124, Nr. 52, 2012, S. 13171–13174, doi:10.1002/ange.201205902.