Aldehyd-Tag
Ein Aldehyd-Tag ist ein Protein-Tag mit einer Aldehydgruppe, das in der Biochemie zur Proteincharakterisierung verwendet wird.[1]
Eigenschaften
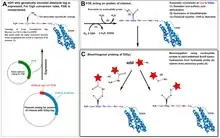
Das Aldehyd-Tag wird vor die Protein-codierende DNA-Sequenz in einem Vektor kloniert. Durch Bindung von und durch Reaktion mit einem Formylglycin-erzeugenden Enzym (englisch formylglycine-generating enzyme, FGE) wird ein Cystein des Protein-Tags zum reaktiven Aldehyd (Formylglycin) umgewandelt.
Anschließend reagiert das Aldehyd selektiv mit Molekülmarkierungen z. B. mit Aminoxy- oder Hydrazidgruppen. Da der optimale saure pH-Wert der Reaktion zelltoxisch ist, wird die Reaktion bei neutralen pH-Werten mit einer erniedrigten Reaktionsrate von etwa 10−4 bis 10−3 M−1 s−1 durchgeführt.[2] Alternativ ist es auch möglich, Reaktionen mit Pyrazolonen zu erzeugen, welche unter physiologischen Bedingungen ablaufen können. Das Aldehyd-Tag wird im Gegensatz zu Methoden der bioorthogonalen Markierung ausschließlich durch Biosynthese ohne markierte Vorläufersubstanzen erzeugt, die reaktive Carbonylgruppe ist jedoch vergleichsweise wenig spezifisch und neigt in Zellen oder Zelllysaten zu Nebenreaktionen mit zellulären Proteinen und anderen Aminen unter Bildung einer Schiff-Base, während die Hydrazid- oder Aminoxid-enthaltenden Moleküle mit zellulären Metaboliten mit Carbonylgruppe reagieren können, z. B. im Kohlenhydratstoffwechsel.[3][4]
Alternativ kann durch eine bioorthogonale Markierung ein dem Aldehyd-Tag analoges Keton-Tag (ebenfalls mit einer Carbonylgruppe) erzeugt werden.[5]
Literatur
- J. A. Prescher, C. R. Bertozzi: Chemical technologies for probing glycans. In: Cell. Band 126, Nummer 5, September 2006, S. 851–854, ISSN 0092-8674. doi:10.1016/j.cell.2006.08.017. PMID 16959565.
Einzelnachweise
- I. S. Carrico, B. L. Carlson, Carolyn Bertozzi: Introducing genetically encoded aldehydes into proteins. In: Nature chemical biology. Band 3, Nummer 6, Juni 2007, S. 321–322, ISSN 1552-4450. doi:10.1038/nchembio878. PMID 17450134.
- W. P. Jencks: Studies on the Mechanism of Oxime and Semicarbazone Formation. In: J. Am. Chem. Soc. (1959), Band 81, S. 475–481.
- R. K. Lim, Q. Lin: Bioorthogonal chemistry: recent progress and future directions. In: Chemical communications. Band 46, Nummer 10, März 2010, S. 1589–1600, ISSN 1364-548X. doi:10.1039/b925931g. PMID 20177591. PMC 2914230 (freier Volltext).
- J. A. Prescher, C. R. Bertozzi: Chemistry in living systems. In: Nature chemical biology. Band 1, Nummer 1, Juni 2005, S. 13–21, ISSN 1552-4450. doi:10.1038/nchembio0605-13. PMID 16407987.
- Z. Zhang, B. A. Smith, L. Wang, A. Brock, C. Cho, P. G. Schultz: A new strategy for the site-specific modification of proteins in vivo. In: Biochemistry. Band 42, Nummer 22, Juni 2003, S. 6735–6746, ISSN 0006-2960. doi:10.1021/bi0300231. PMID 12779328.