Adenylierung
Die Adenylierung (auch Adenylylierung) ist eine posttranslationale Modifikation von Proteinen, bei der eine Adenosinmonophosphat-Gruppe angehängt wird.[1][2][3]
Eigenschaften
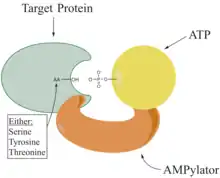
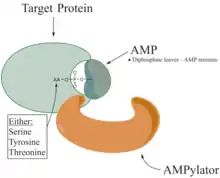
Die adenylierte Aminosäure im Protein ist z. B. ein Tyrosin. Die Adenylierung eines Proteins erfolgt durch Reaktion einer Hydroxygruppe, Aminogruppe oder Sulfhydrylgruppe des Proteins mit Adenosintriphosphat, bei der Pyrophosphat abgespalten wird.[4]
Das Ausmaß der Adenylierung der Glutamin-Synthetase hängt von dem Verhältnis von Glutamin zu α-Ketoglutarat ab. Je größer das Verhältnis, desto mehr erfolgt eine Adenylierung bei den Monomeren, wodurch ihre Enzymaktivität abnimmt. Daher ist die Adenylierung ein Anzeichen für ausreichende Konzentrationen an Glutamin-gebunden Amin, eine geringe Adenylierung dagegen zu einer verstärkten Fixierung von Ammoniak durch die Glutamin-Synthetase.
Die adenylierenden Enzyme der ANL-Familie umfassen z. B. Acyl- und Aryl-CoA-Synthetasen, die firefly luciferase und die Adenylierungs-Domänen der modularen nicht-ribosomalen Peptidsynthetasen (NRPS).[5] In NRPS erfolgt durch die Adenylierung die Initiation der Proteinbiosynthese durch Aktivierung der Aminosäure.[6]
Einzelnachweise
- K. K. Han, A. Martinage: Post-translational chemical modification(s) of proteins. In: The International journal of biochemistry. Band 24, Nummer 1, 1992, S. 19–28, PMID 1582530.
- R. H. Garrett, C. M. Grisham in: Biochemistry, 3rd ed. Belmont, CA: Thomas, 2007, S. 815–820.
- M. P. Müller, M. F. Albers, A. Itzen, C. Hedberg: Exploring adenylylation and phosphocholination as post-translational modifications. In: ChemBioChem Band 15, Nummer 1, Januar 2014, S. 19–26, doi:10.1002/cbic.201300508. PMID 24174209.
- B. P. Duckworth, K. M. Nelson, C. C. Aldrich: Adenylating enzymes in Mycobacterium tuberculosis as drug targets. In: Current Topics in Medicinal Chemistry. Band 12, Nummer 7, 2012, S. 766–796, PMID 22283817. PMC 3808994 (freier Volltext).
- A. M. Gulick: Conformational dynamics in the Acyl-CoA synthetases, adenylation domains of non-ribosomal peptide synthetases, and firefly luciferase. In: ACS Chemical Biology. Band 4, Nummer 10, Oktober 2009, S. 811–827, doi:10.1021/cb900156h. PMID 19610673. PMC 2769252 (freier Volltext).
- A. Koglin, C. T. Walsh: Structural insights into nonribosomal peptide enzymatic assembly lines. In: Natural Product Reports. Band 26, Nummer 8, August 2009, S. 987–1000, doi:10.1039/b904543k. PMID 19636447. PMC 2773127 (freier Volltext).