31P-Magnetresonanzspektroskopie
Die 31P-Magnetresonanzspektroskopie (31P-MRS) ist eine spezielle Form der Magnetresonanztomographie, bei der die relativen Konzentrationen bestimmter Substanzen, etwa die Phosphate des Energiestoffwechsels, im Gewebe bestimmt werden. Sie wird hauptsächlich in wissenschaftlichen Studien zur Muskelphysiologie und Sportmedizin eingesetzt.[1]
Grundlagen
Die 31-Phosphor-Magnetresonanz-Spektroskopie erlaubt nicht-invasiv einen Einblick in die mitochondriale Funktion der Muskelzellen. Sie wurde von der NMR-Spektroskopie abgeleitet, wobei das natürlich vorkommende Isotop des Phosphors mit einer spezifischen Frequenz von 25,8 MHz bei einem Magnetfeld von 1,5 Tesla angeregt wird. Bei Verwendung einer klinischen Magnetresonanztomografie (MRT) Anlage mit der Fähigkeit zur Spektroskopie bei einem Magnetfeld zwischen 1,5 und 3 Tesla können quantitativ Veränderungen von Phosphokreatin (PCr), anorganischen Phosphat, Phosphomonoester und Phosphodiester sowie den α-, β- und γ-Phosphaten des Adenosintriphosphats (ATP) nachgewiesen werden. Allerdings findet bei der α- und γ-Position eine Überlagerung mit den Phosphaten von ADP und Nicotinamidadenindinukleotid (NAD+/NADH) statt. Die β-Position von ATP wird nicht von anderen Phosphaten überlagert und kann somit für eine Quantifizierung von ATP herangezogen werden.[2]
Um Metabolitenveränderungen im Muskel unter Belastung zu messen, wird eine hohe zeitliche Auflösung angestrebt, die in einem Bereich zwischen 4 und 20 s liegt. Dadurch können die Veränderungen vor allem zu Beginn einer Belastung gut erfasst werden.[3]
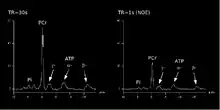
Quantifizierung der Metaboliten
Es gibt verschiedene Methoden, um die Metaboliten, die mittels der 31P-MRS im Muskel gemessen werden, zu quantifizieren. Eine Möglichkeit ist, einen externen Standard zu benutzen, der in die Messanordnung eingebracht wird. Phenylphosphonsäure [10mM] ist ein Beispiel für einen solchen externen Standard, der zusammen mit den Metaboliten im Muskel gemessen wird. Da die Konzentration des externen Standards bekannt ist, können die Konzentrationen der übrigen Metaboliten gemessen werden. Ein Problem dieser Methode ist allerdings der Umstand, dass der externe Standard sich außerhalb des lebenden Körpers befindet und somit nur bedingt mit Metaboliten innerhalb des Körpers vergleichbar ist.[4]
Eine andere Methode besteht darin, ATP als sogenannten internen Standard zu benutzen. Die ATP-Konzentration im Ruhezustand des Muskels weist nur eine geringe Variabilität zwischen verschiedenen Menschen auf und wird gewöhnlich mit 8,2 mmol/l angegeben. Der Vorteil liegt darin, dass das ATP intracellulär liegt und somit den gleichen Bedingungen der zu quantifizierenden Metaboliten unterworfen ist. Diese Methode der Quantifizierung wird überwiegend verwendet.[5]
Um Metaboliten quantifizieren zu können, müssen die Partialsaturierungen, die durch unterschiedliche Relaxationszeiten der Metaboliten zustande kommen, ausgeglichen werden. Bei einem voll saturierten Spektrum, das gewöhnlich mit einer Repetitionszeit von 30 s gemessen wird, spielen die unterschiedlichen Relaxationszeiten keine Rolle. Da es allerdings notwendig ist, die dynamischen Veränderungen im Muskel unter Belastung mit einer höheren zeitlichen Auflösung als 30 s aufzuzeichnen, wird hierzu eine viel niedrigere Repetitionszeit verwendet. Da die Metaboliten mit einer unterschiedlichen Zeit während der Messung relaxieren, verändert sich das Verhältnis der Integrale unter den Peaks zueinander. Dieses Verhältnis stimmt nicht mehr mit den tatsächlichen Konzentrationen überein und muss korrigiert werden. Es ist möglich im Ruhezustand vor dem Belastungsprotokoll eine voll relaxiertes Spektrum mit Hilfe einer Repetitionszeit von 30 s zu gewinnen, das dann herangezogen wird, um die Verhältnisse der Metaboliten zueinander zu korrigieren. Die Konzentrationen der Metaboliten können aber auch rechnerisch bei einer konstanten Repetitionszeit über die bekannten Relaxationszeiten korrigiert werden.[6]
Veränderungen der energiereichen Phosphate zu Beginn einer Muskelarbeit
Zu Beginn einer Muskelarbeit wird durch die Kontraktionen vermehrt Adenosintriphosphat an den Myofibrillen gespalten. Dadurch fallen vermehrt Adenosindiphosphat (ADP) und anorganisches Phosphat (P) sowie [H+]-Ionen an. Die Kreatinkinase bei den Myofibrillen überträgt nun ein Phosphat des PCr auf das ADP, welches so zu ATP rephosphoryliert wird. Das verbleibende Kreatin wird an den Mitochondrien im Zytosol zu PCr unter Verbrauch von ATP rephosphoryliert. Diese Reaktion wird von einer Kreatinkinase an der äußeren Membran der Mitochondrien mediiert. PCr ist somit ein Shuttle für den Transport energiereicher Phosphate von den Mitochondrien zu den Myofibrillen.[7][8]
Die ATP-Produktion in den Mitochondrien ist am Anfang zu gering, um das akkumulierende Kreatin komplett zu rephosphorylieren. Dadurch kommt es zu einem progredienten PCr-Abfall im Zytosol. Man spricht hier auch von der anaeroben Phase, da die Muskelzelle versucht, den ATP-Bedarf durch die Milchsäuregärung zu decken. Dies gelingt nicht, so dass der progrediente PCr-Abfall nicht aufgehalten werden kann. Aber dadurch entsteht Lactat, das als Puffer für die bei der ATP-Hydrolyse entstehenden [H+] Ionen dient.[9]
Gleichgewichtszustand der Veränderungen der energiereichen Phosphate
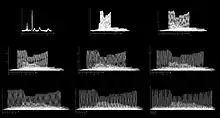
Im weiteren Verlauf wird die mitochondriale Kapazität gemäß den metabolischen Anforderungen durch Enzymaktivierung und durch Verbesserung der Sauerstoffzufuhr mittels einer gesteigerten Gewebeperfusion erhöht. Dadurch geht die Phase des progredienten PCr Zerfalls in ein Gleichgewicht von PCr-Hydrolyse und Rephosphorylierung über. Dieses Gleichgewicht stellt sich gewöhnlich in einem monoexponentiellen Verlauf ein. Die Zeitkonstanten, die den Zeitpunkt des Umschlags von progredienten PCr-Abfall zum Gleichgewichtszustand angeben, betragen bei gesunden Menschen zwischen 30 und 60 Sekunden und korrelieren auch mit der Erhöhung des Blutflusses in den zuführenden Arterien.[10][11][12]
Neuere Untersuchungen haben auch gezeigt, dass bei einer inkrementellen Muskelbelastung der Blutfluss in der zuführenden Arterie mit Erhöhung der Arbeitsintensität ansteigt. Dabei kommt es in jedem Inkrement zu einer Gleichgewichtseinstellung des PCr-Zerfalls. Die PCr-Level am Ende eines Inkrements zeigen eine lineare Korrelation zu der Arbeitsintensität des Muskels.[13]
Berechnung der Zeitkonstanten der Phosphokreatin-Veränderungen
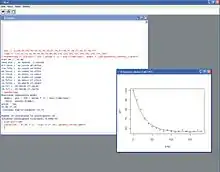
Der Zeitlauf von PCr wird mit Hilfe einer nicht-linearen Regressionsanalyse bzw. Kurvenanpassung untersucht, wobei überwiegend ein mono-exponentielles Modell verwendet wird. Dadurch kann die Zeitkonstante des PCr-Verlaufes geschätzt werden, die angibt, zu welchem Zeitpunkt der progrediente Anteil der PCr-Abfall in das Plateau übergeht, das der aeroben Phase entspricht. Die PCr-Zeitkonstanten korrelieren auch mit dem mitochondrialen Sauerstoffumsatz und sind somit auch ein Hinweis für die mitochondriale Funktion. Speziell die PCr-Zeitkonstante während der Regenerationszeit hängt fast ausschließlich von der mitochondrialen Funktion ab. Die Berechnung der PCr-Zeitkonstanten kann im Statistikprogramm SPSS vorgenommen werden. Weitere geeignete Programme sind auch Origin oder GNU R.[14]
Phosphokreatin-Kinetik und mitochondriale Funktion
PCr ist ein Shuttle-Molekül, das energiereiche Phosphate vom Mitochondrium zur Myofibrille transportiert, damit das ADP, das während der Muskelkontraktion anfällt, zu ATP regeneriert werden kann. Dadurch kann unter aeroben Bedingungen das ATP an der Myofibrille konstant gehalten werden. An der Myofibrille wird das ATP durch eine ATPase bei deren Kontraktion gespalten. Bei der Übertragung der energiereichen Phosphatgruppe vom PCr auf das ADP bleibt Kreatin zurück. Das Kreatin wird am Mitochondrium unter ATP-Spaltung wieder rephosphoryliert.[7][8] Da das Kreatin nur zu PCr rephosphoryliert wird, wenn die ATP-Synthese am Mitochondrium dafür ausreicht, kann über die PCr-Kinetik auf die mitochondriale Funktion und den mitochondrialen Sauerstoffumsatz zurückgeschlossen werden.[15]
Es ist auch anerkannt, dass insbesondere die Regeneration des PCr nach einer Belastung ein Spiegel der mitochondrialen Funktion ist. Ist die Zeitkonstante der PCr-Regeneration verlängert, liegt eine mitochondriale Funktionsstörung vor.[16]
Ergometer
Für diese Untersuchung wird ein MR-kompatibler Ergometer benötigt, um im Muskel eine Energieabgabe zu erzeugen, die dann zu den oben beschriebenen metabolischen Verschiebungen im Muskel führt. Der Ergometer sollte über einen Zeitraum von mehreren Minuten eine konstante Energieabgabe ermöglichen. Da diese Methode hauptsächlich für wissenschaftliche Fragestellungen benützt wird, verwenden die meisten Arbeitsgruppen Eigenbauvarianten, die die Energieabgabe über Luftdruck, Seilzüge mit Gewichten oder Gummibändern bewerkstelligen.[17][18][19] Da die Wadenmuskulatur in einer MRT-Anlage relativ einfach zu belasten ist, wird diese häufig untersucht. Deshalb existieren auch relativ viele Varianten von Pedalergometern.
Anwendungen
Die 31P-MRS zur Untersuchung des Stoffwechsels der energiereichen Phosphate im Muskel wird hauptsächlich in der Muskelphysiologie und Sportmedizin eingesetzt.[1][20] Andere Anwendungsgebiete sind metabolische Erkrankungen sowie Speichererkrankungen wie zum Beispiel der Morbus McArdle.[21][22] Bei diesen Erkrankungen kommt es meist zu einer Beeinträchtigung der mitochondrialen Funktion, die mittels der 31P-MRS des Skelettmuskels unter Belastung gemessen und quantifiziert werden kann. Auch andere angeborene und erworbene Mitochondropathien können damit untersucht werden.[23] In den letzten Jahren ist diese Methode vermehrt zur wissenschaftlichen Untersuchung des Energiestoffwechsel in der Wadenmuskulatur bei Patienten mit peripherer arterieller Verschlusskrankheit (pAVK) herangezogen worden.[3]
Einzelnachweise
- Taylor. Clinical utility of muscle MR spectroscopy. Semin Musculoskelet Radiol. 4(4), 2000, S. 481–502.
- Stubbs et al. 31P-magnetic resonance spectroscopy studies of nucleated and non-nucleated erythrocytes; time domain data analysis (VARPRO) incorporating prior knowledge can give information on the binding of ADP. Biochim Biophys Acta 1291, 1996, S. 143–148.
- Schocke et al. High-energy phosphate metabolism in the exercising muscle of patients with peripheral arterial disease. VASA 37, 2008, S. 199–210.
- Hitchins et al. 31P NMR quantitation of phosphorus metabolites in rat heart and skeletal muscle in vivo. Am J Physiol-Heart Circul Physiol 281, 2001, S. H882-H887.
- Kemp et al. Absolute quantification of phosphorus metabolite concentrations in human muscle in vivo by 31P MRS: a quantitative review. NMR Biomed 20, 2007, S. 555–565.
- Meyerspeer et al. Relaxation times of 31P-metabolites in human calf muscle at 3 T. Magn Reson Med. 49, 2003, S. 620–625.
- Mahler. First-order kinetics of muscle oxygen consumption, and an equivalent proportionality between QO2 and phosphorylcreatine level. Implications for the control of respiration. J Gen Physiol. 86, 1985, S. 135–165.
- Meyer. A linear model of muscle respiration explains monoexponential phosphocreatine changes. Am J Physiol-Cell Physiol. 254, 1988, S. C548–C553.
- Robergs et al. Biochemistry of exercise-induced metabolic acidosis. Am J Physiol-Regul Integr Comp Physiol. 287, 2004, S. R502–R516.
- Iotti et al. Inorganic phosphate is transported into mitochondria in the absence of ATP biosynthesis: an in vivo 31P NMR study in the human skeletal muscle. Biochem Biophys Res Commun. 225, 1996, S. 191–194.
- Binzoni. Human skeletal muscle energy metabolism: when a physiological model promotes the search for new technologies. Eur J Appl Physiol. 90, 2003, S. 260–269.
- Iotti et al. The mono-exponential pattern of phosphocreatine recovery after muscle exercise is a particular case of a more complex behaviour. Biochim Biophys Acta. 1608, 2004, S. 131–139.
- Greiner et al. High-energy phosphate metabolism in the calf muscle of healthy humans during incremental calf exercise with and without moderate cuff stenosis. Eur J Appl Physiol. 99(5), 2007, S. 519–531.
- Nevill et al. A model for phosphocreatine resynthesis. J Appl Physiol. 82, 1997, S. 329–335.
- Lai et al. Linking pulmonary oxygen uptake, muscle oxygen utilization and cellular metabolism during exercise. Ann Biomed Eng. 35(6), 2007, S. 956–69.
- Forbes et al. Short-term high-intensity interval training improves phosphocreatine recovery kinetics following moderate-intensity exercise in humans. Appl Physiol Nutr Metab. 33(6), 2008, S. 1124–31.
- Quistorff et al. A simple calf muscle ergometer for use in a standard whole-body MR scanner. Magn Reson Med. 13, 1990, S. 444–449.
- Francescato et al. Two-pedal ergometer for in vivo MRS studies of human calf muscles. Magn Reson Med 46, 2001, S. 1000–1005.
- Duteil et al. Metabolic and vascular support for the role of myoglobin in humans: a multiparametric NMR study. Am J Physiol Regul Integr Comp Physiol. 287, 2004, S. R1441-1449.
- Prompers et al. Dynamic MRS and MRI of skeletal muscle function and biomechanics. NMR Biomed. 19(7), 2006, S. 927–53.
- Phielix et al. Type 2 diabetes mellitus and skeletal muscle metabolic function. Physiol Behav. 94(2), 2008, S. 252–8.
- Vorgerd et al. Treatment of glycogenosys type V (McArdle disease) with creatine and ketogenic diet with clinical scores and with 31P-MRS on working leg muscle. Acta Myol. 26(1), 2007, S. 61–3.
- Boesch. Musculoskeletal spectroscopy. J Magn Reson Imaging. 25(2), 2007, S. 321–38.