1,2-Wittig-Umlagerung
Die 1,2-Wittig-Umlagerung ist eine Namensreaktion in der Organischen Chemie. Sie wurde 1942 vom späteren Nobelpreisträger, dem deutschen Chemiker Georg Wittig (1897–1987) erstmals beschrieben und später nach ihm benannt.[1][2]
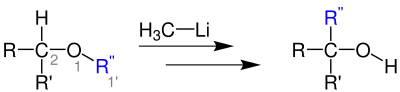
Bei der 1,2-Wittig-Umlagerung wird ein Ether mittels einer Organolithium-Verbindung (z. B. Methyllithium) zu einem Alkohol umgelagert.
Reaktionsmechanismus
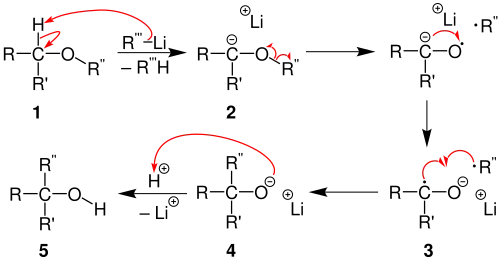
Im ersten Schritt der Reaktion wird der Ether 1 mittels einer Organolithium-Verbindung deprotoniert. Durch homolytischen Bindungsbruch und anschließende Umlagerung bilden sich aus dem Anion 2 ein Ketylanion-Radikal 3 und ein Alkyl-Radikal. Durch Rekombination der beiden Radikale entsteht das Lithium-Alkoholat 4 und schließlich durch saure Aufarbeitung der substituierte Alkohol 5.[3][4][5]
Einfluss der Substituenten
Das Gelingen der 1,2-Wittig-Umlagerung wird in großem Maße durch die Substituenten des Edukts bestimmt:
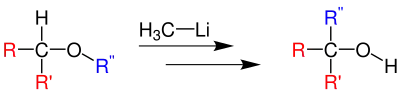
Mindestens einer der beiden Substituenten R und R' muss in der Lage sein, das im ersten Reaktionsschritt gebildete Carbanion 2 zu stabilisieren. In Frage kommen deshalb Aryl-, Alkenyl- und Alkinylreste.[4] Für den umgelagerten Rest R'' ist dessen Wanderungstendenz als Radikal entscheidend. Es besteht folgende Reihenfolge mit zunehmender Wanderungstendenz: Methyl < primäre Alkylgruppe < sekundäre Alkylgruppe < tertiäre Alkylgruppe < Benzylgruppe < Allylgruppe.[6][7]
Handelt es sich bei R'' um eine Allylgruppe, verläuft die 1,2-Umlagerung zudem in Konkurrenz zur 2,3-Wittig-Umlagerung.
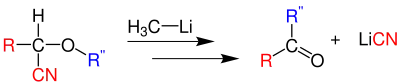
Wenn es sich bei R oder R' um eine gute Abgangsgruppe und elektronenziehende Gruppe (z. B. Cyanid) handelt, wird diese Gruppe abgespalten und das entsprechende Keton gebildet:[8]
Einzelnachweise
- Georg Wittig, Lisa Löhmann: Übe die kationtrope Isomerisation gewisser Benzyläther bei Einwirkung von Phenyl-lithium. In: Justus Liebigs Annalen der Chemie. 550, Nr. 1, 1942, S. 260–268, doi:10.1002/jlac.19425500117.
- G. Wittig: Ergebnisse und Probleme der organischen Anionochemie. In: Experientia. 14, Nr. 11, 1958, S. 389–395, doi:10.1007/BF02160421.
- Jie Jack Li: Name reactions, a collection of detailed reaction mechanism. 5. Edition. Springer 2014. S. 636–637. ISBN 978-3-319-03979-4.
- László Kürti, Barbara Czakó: Strategic Applications of Named Reactions in Organic Synthesis. Elsevier Academic Press, Burlington/San Diego/London 2005, S. 490–491, ISBN 0-12-369483-3.
- Sven Strunk, Manfred Schlosser: Wittig Rearrangement of Lithiated Allyl Aryl Ethers: A Mechanistic Study. In: European Journal of Organic Chemistry. 2006, Nr. 19, 2006, S. 4393–4397, doi:10.1002/ejoc.200600304.
- Katsuhiko Tomooka, Hiroshi Yamamoto, Takeshi Nakai: Recent Developments in the [1,2]-Wittig Rearrangement. In: Liebigs Ann. Chem. 1997, Nr. 7. S. 1275–1281. doi:10.1002/jlac.199719970703.
- Wolfgang Uhl, Apostolos Kyriatsouilis: Namen- und Schlagwortreaktionen in der Organischen Chemie. Vieweg-Verlag 1984. S. 160–162. ISBN 3-528-03581-1.
- Alan R. Katritzky, Yuming Zhang, Sandeep K. Singh: Preparation of aryl benzyl ketones by [1, 2]-Wittig rearrangement. In: Arkivoc. 7, 2002, S. 146–150 (PDF (Memento vom 28. September 2006 im Internet Archive); 47 kB).