ε-Globin
ε-Globin, epsilon-Globin, oder Hämoglobin epsilon-Kette ist ein Protein aus der Familie der Globine, dessen 147 Aminosäuren lange Polypeptidkette ein Häm als Cofaktor bindet und das so Teil des Proteinkomplexes von embryonalen Hämoglobinen ist – bei Hb Gower-1 (ζ2ε2) und bei Hb Gower-2 (α2ε2) –, die Hämoglobin-Untereinheit epsilon (HBE oder HBE1).
| Ε-Globin | ||
|---|---|---|
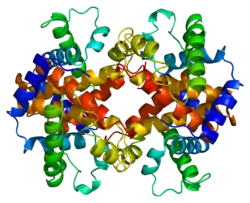
| ||
| Struktur von ε-Globin im Homotetramer | ||
| Kofaktor | Häm | |
| Bezeichner | ||
| Gen-Name(n) | HBE; HBE1 | |
| Externe IDs | ||
Das ε-Globin ist ein Bestandteil von Hämoglobin-Varianten, die in der Embryonalperiode für den Sauerstofftransport gebildet werden. Beim Menschen wird es vom HBB-Gen codiert, das im Gen-Cluster des β-Globin-Locus (5′ - HBE1 – HBG2 – HBG1 – HBD – HBB-3′)[1] auf Chromosom 11 liegt. Die Expression dieser einander sehr ähnlichen Gene wird hier über eine gemeinsame Kontrollregion geregelt und ist entwicklungsabhängig unterschiedlich. Je nach Entwicklungsphase bzw. Zellmilieu kann die Proteinbiosynthese von entsprechenden ε-, γ-, δ- oder β-Globinen veranlasst werden.[2] Diese Proteine unterscheiden sich voneinander nur in wenigen Aminosäuren ihrer jeweils 147 AS langen Kette; doch zeigen die aus ihnen zusammengesetzten Hämoglobine Unterschiede im Sauerstoff-Bindungsvermögen.
Funktion
In der menschlichen Embryogenese wird zunächst das Gen für epsilon-Globin (HBE) aktiviert. Schon während der dritten Entwicklungswoche bilden Zellen in den noch extraembryonal gelegenen Blutinseln des Dottersacks bzw. Nabelschnurbläschens die ersten (embryonalen) Hämoglobine. Diese Proteinkomplexe setzen sich aus vier häm-bindenden Globin-Untereinheiten zusammen, die sich paarweise gleichen. Beim embryonalen Hämoglobin „Hb Gower I“ bestehen die beiden Paare aus epsilon-Kette und zeta-Kette – ζ2ε2); beim „Hb Gower II“ sind es epsilon-Ketten und alpha-Ketten – α2ε2. Beide dieser embryonalen Hämoglobine werden später normalerweise durch fötales Hämoglobin (HbF – α2γ2) und anschließend durch die Hämoglobine Erwachsener (HbA(1) – α2β2; HbA2 – α2δ2) verdrängt.
Einzelnachweise
- Entrez Gene: HBE1 hemoglobin, epsilon 1. Abgerufen am 19. Mai 2012.
- Higgs DR, Vickers MA, Wilkie AO, Pretorius IM, Jarman AP, Weatherall DJ: A review of the molecular genetics of the human alpha-globin gene cluster. In: Blood. 73, Nr. 5, Mai 1989, S. 1081–104. PMID 2649166.
Literatur
- Clegg JB: Embryonic hemoglobin: sequence of the epsilon and zeta chains.. In: Tex. Rep. Biol. Med.. 40, 1982, S. 23–8. PMID 6172865.
- Giardina B, Messana I, Scatena R, Castagnola M: The multiple functions of hemoglobin.. In: Crit. Rev. Biochem. Mol. Biol.. 30, Nr. 3, 1995, S. 165–96. doi:10.3109/10409239509085142. PMID 7555018.
- Chang JC, Kan YW: beta 0 thalassemia, a nonsense mutation in man.. In: Proc. Natl. Acad. Sci. USA. 76, Nr. 6, 1979, S. 2886–9. doi:10.1073/pnas.76.6.2886. PMID 88735. PMC 383714 (freier Volltext).
- Proudfoot NJ, Baralle FE: Molecular cloning of human epsilon-globin gene.. In: Proc. Natl. Acad. Sci. U.S.A.. 76, Nr. 11, 1980, S. 5435–9. doi:10.1073/pnas.76.11.5435. PMID 160554. PMC 411663 (freier Volltext).
- Proudfoot NJ, Brownlee GG: 3' non-coding region sequences in eukaryotic messenger RNA.. In: Nature. 263, Nr. 5574, 1976, S. 211–4. doi:10.1038/263211a0. PMID 822353.
- Marotta CA, Forget BG, Cohne-Solal M, et al.: Human beta-globin messenger RNA. I. Nucleotide sequences derived from complementary RNA.. In: J. Biol. Chem.. 252, Nr. 14, 1977, S. 5019–31. PMID 873928.
- Gelinas R, Endlich B, Pfeiffer C, et al.: G to A substitution in the distal CCAAT box of the A gamma-globin gene in Greek hereditary persistence of fetal haemoglobin.. In: Nature. 313, Nr. 6000, 1985, S. 323–5. doi:10.1038/313323a0. PMID 2578619.
- Collins FS, Metherall JE, Yamakawa M, et al.: A point mutation in the A gamma-globin gene promoter in Greek hereditary persistence of fetal haemoglobin.. In: Nature. 313, Nr. 6000, 1985, S. 325–6. doi:10.1038/313325a0. PMID 2578620.
- Lang KM, Spritz RA: Cloning specific complete polyadenylylated 3'-terminal cDNA segments.. In: Gene. 33, Nr. 2, 1985, S. 191–6. doi:10.1016/0378-1119(85)90093-9. PMID 2581851.
- Ley TJ, Maloney KA, Gordon JI, Schwartz AL: Globin gene expression in erythroid human fetal liver cells.. In: J. Clin. Invest.. 83, Nr. 3, 1989, S. 1032–8. doi:10.1172/JCI113944. PMID 2921315. PMC 303780 (freier Volltext).
- Chabot B, Black DL, LeMaster DM, Steitz JA: The 3' splice site of pre-messenger RNA is recognized by a small nuclear ribonucleoprotein.. In: Science. 230, Nr. 4732, 1986, S. 1344–9. doi:10.1126/science.2933810. PMID 2933810.
- Engelke DR, Hoener PA, Collins FS: Direct sequencing of enzymatically amplified human genomic DNA.. In: Proc. Natl. Acad. Sci. U.S.A.. 85, Nr. 2, 1988, S. 544–8. doi:10.1073/pnas.85.2.544. PMID 3267215. PMC 279587 (freier Volltext).
- Fei YJ, Stoming TA, Efremov GD, et al.: Beta-thalassemia due to a T----A mutation within the ATA box.. In: Biochem. Biophys. Res. Commun.. 153, Nr. 2, 1988, S. 741–7. doi:10.1016/S0006-291X(88)81157-4. PMID 3382401.
- Prchal JT, Cashman DP, Kan YW: Hemoglobin Long Island is caused by a single mutation (adenine to cytosine) resulting in a failure to cleave amino-terminal methionine.. In: Proc. Natl. Acad. Sci. U.S.A.. 83, Nr. 1, 1986, S. 24–7. doi:10.1073/pnas.83.1.24. PMID 3455755. PMC 322783 (freier Volltext).
- van Santen VL, Spritz RA: mRNA precursor splicing in vivo: sequence requirements determined by deletion analysis of an intervening sequence.. In: Proc. Natl. Acad. Sci. U.S.A.. 82, Nr. 9, 1985, S. 2885–9. doi:10.1073/pnas.82.9.2885. PMID 3857622. PMC 397671 (freier Volltext).
- Ruskin B, Greene JM, Green MR: Cryptic branch point activation allows accurate in vitro splicing of human beta-globin intron mutants.. In: Cell. 41, Nr. 3, 1985, S. 833–44. doi:10.1016/S0092-8674(85)80064-7. PMID 3879973.
- Tuan D, Solomon W, Li Q, London IM: The „beta-like-globin“ gene domain in human erythroid cells.. In: Proc. Natl. Acad. Sci. U.S.A.. 82, Nr. 19, 1985, S. 6384–8. doi:10.1073/pnas.82.19.6384. PMID 3879975. PMC 390720 (freier Volltext).
- Orkin SH, Antonarakis SE, Kazazian HH: Base substitution at position -88 in a beta-thalassemic globin gene. Further evidence for the role of distal promoter element ACACCC.. In: J. Biol. Chem.. 259, Nr. 14, 1984, S. 8679–81. PMID 6086605.