β-Lactamase-Inhibitoren
β-Lactamase-Inhibitoren haben eine ähnliche chemische Struktur wie β-Lactam-Antibiotika, haben allerdings – bis auf Sulbactam – keine antibakterielle Wirkung. Sie binden irreversibel an das Enzym β-Lactamase, welches von einigen Bakterien produziert wird, und verhindern dadurch die Inaktivierung der β-Lactam-Antibiotika. Dadurch erhöhen sie die Wirkung der β-Lactam-Antibiotika.
β-Lactamase-Inhibitoren werden meist in Kombination mit β-Lactam-Antibiotika verwendet. Zum Beispiel enthält das Breitbandantibiotikum Augmentan das β-Lactam-Antibiotikum Amoxicillin und den β-Lactamase-Inhibitor Clavulansäure, oder Tazobactam ist in Kombination mit Piperacillin im Handel, ebenso Sulbactam mit Ampicillin.
Im Februar 2015 erteilte die US-amerikanische Gesundheitsbehörde (FDA) der Kombination des β-Lactamase-Inhibitors Avibactam mit Ceftazidim (Handelsname in den USA: Avycaz; AstraZeneca) die Zulassung.[1] Avibactam wurde am 28. April 2016 von der European Medicines Agency nur als Kombinationspräparat mit Ceftazidim in Europa zugelassen und wird von der Firma AstraZeneca unter dem Handelsnamen Zavicefta® vertrieben.[2]
Ein noch in klinischer Prüfung befindlicher β-Lactamase-Inhibitor, Vaborbactam, soll zusammen mit dem β-Lactam-Antibiotikum Meropenem verabreicht werden. Im April 2016 erhielt die Kombination von der FDA die Fast Track Designation, also ein beschleunigtes Zulassungsverfahren für Arzneimittel, wenn einem Medikament das Potenzial zuerkannt wird, lebensbedrohliche Krankheiten zu behandeln.[3]
Relebactam wurde in fixer Kombination mit Imipenem und Cilastatin im Juli 2019 in den USA zugelassen.[4]
- β-Lactamase-Inhibitoren


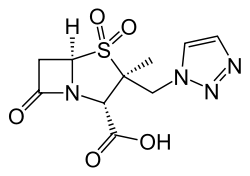
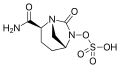 Avibactam (2015)
Avibactam (2015)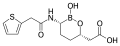 Vaborbactam (2017)
Vaborbactam (2017)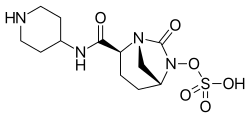 Relebactam (2019)
Relebactam (2019)
Literatur
- W. R. Heizmann, P. Heizmann: Vademecum Infektiologie. 2007
Einzelnachweise
- FDA approves new antibacterial drug Avycaz. FDA, Pressemitteilung, 25. Februar 2015, abgerufen am 30. April 2016
- Zulassungsbericht der EMA. Abgerufen am 18. Januar 2022.
- FDA Grants Fast Track Status for Investigational Antibiotic CARBAVANCE® (meropenem-vaborbactam). The Medicines Company, Pressemitteilung, 11. April 2016; abgerufen am 26. April 2016
- Center for Drug Evaluation and Research: Novel Drug Approvals for 2019. In: FDA. 25. Januar 2021 (fda.gov [abgerufen am 18. Januar 2022]).