Trastuzumab-Emtansin
Trastuzumab-Emtansin (T-DM1, Handelsname Kadcyla) ist ein Antikörper-Wirkstoff-Konjugat, das seit November 2013 zur Behandlung von Patienten mit HER2-positivem (den humanen epidermalen Wachstumsfaktor-Rezeptor 2 überexprimierenden), inoperablem, lokal fortgeschrittenem oder metastasiertem Brustkrebs zugelassen.[2] Es enthält das Maytansinoid DM1, einen Mikrotubuli-Inhibitor, welches über einen Linker mit dem Antikörper Trastuzumab verbunden ist.[3]
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
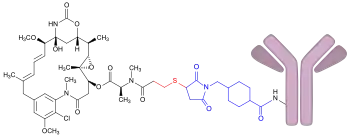 | ||||||||||
| Trastuzumab-Emtansin: Das Maytansinoid DM1, gebunden an den monoklonalen Antikörper Trastuzumab (rosa). Der Teil, in dem sich DM1 von seiner Ausgangsverbindung Maytansin unterscheidet, ist rot und der Linker SMCC ist blau dargestellt. | ||||||||||
| Allgemeines | ||||||||||
| Name | Trastuzumab-Emtansin | |||||||||
| Andere Namen |
| |||||||||
| Summenformel | C6448H9948N1720O2012S44 · 2 Oligosaccharid-Reste · (C47H61ClN4O13S)n (n = ca. 3,5) | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Arzneistoffangaben | ||||||||||
| ATC-Code |
L01XC14 | |||||||||
| Eigenschaften | ||||||||||
| Molare Masse | ca. 151 kDa (Glycoprotein) | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
In der KATHERINE-Studie wurde geprüft, ob Trastuzumab-Emtansin die Prognose von Her2-positivem Mammakarzinom verbessert, wenn nach einer neoadjuvanten (Behandlung vor der Operation) Therapie mit einem Taxan und Trastuzumab Tumorreste verblieben waren.[4] Es ist bekannt, dass Brustkrebspatienten, deren Tumor sich durch eine neoadjuvante Behandlung unzureichend zurückbildet, eine schlechte Prognose haben.[5] In dieser Phase-III-Studie konnte mit der postoperativen Gabe von 14 Zyklen T-DM1 das Risiko eines Tumorrezidivs oder eines Versterbens um 50 % gegenüber einer Therapie mit Trastuzumab gesenkt werden. Allerdings war die Rate an Nebenwirkungen, insbesondere Thrombopenie und Hypertonie unter T-DM1 höher als unter Trastuzumab.
Das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) bescheinigte dem Antikörper-Wirkstoff-Konjugat im April 2014 einen Hinweis auf erheblichen Zusatznutzen.[6]
Einzelnachweise
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Kadcyla - trastuzumab emtansine, Europäischer öffentlicher Beurteilungsbericht (EPAR) und Produktinformation zu Kadcyla auf der Website der Europäischen Arzneimittelagentur (EMA), abgerufen am 1. April 2014.
- ado-trastuzumab emtansine. Abgerufen am 21. März 2015.
- Gunter von Minckwitz, Chiun-Sheng Huang, Max S Mano, Sibylle Loibl, Eleftherios P Mamounas: Trastuzumab Emtansine for Residual Invasive HER2-Positive Breast Cancer. In: The New England Journal of Medicine. Band 380, Nr. 7, 2019, S. 617–628, doi:10.1056/NEJMoa1814017, PMID 30516102.
- Michael Untch, Peter A Fasching, Gottfried E Konecny, Stephan Hasmüller, Annette Lebeau: Pathologic complete response after neoadjuvant chemotherapy plus trastuzumab predicts favorable survival in human epidermal growth factor receptor 2-overexpressing breast cancer: results from the TECHNO trial of the AGO and GBG study groups. In: Journal of Clinical Oncology: Official Journal of the American Society of Clinical Oncology. Band 29, Nr. 25, 1. September 2011, S. 3351–3357, doi:10.1200/JCO.2010.31.4930, PMID 21788566.
- Trastuzumab Emtansin: Bei metastasiertem Brustkrebs mit Anthracyclin-Vorbehandlung Hinweis auf erheblichen Zusatznutzen, PM des IQWiG vom 1. April 2014, abgerufen am 1. April 2014.