Sulfenamide
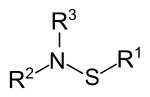
Sulfenamide gehören zu den Organoschwefelverbindungen und sind die Amide der Sulfensäuren. Die Verbindungen werden durch die Strukturformel R1S–NR2R3 beschrieben (R1, R2, R3 = H-, Alkyl- oder Arylrest).[1] Sulfenamide werden insbesondere bei der Vulkanisation von Gummi verwendet. Die Sauerstoffverbindungen der Sulfenamide sind die Sulfinamide (R1SO–NR2R3) und Sulfonamide (R1SO2–NR2R3).
Herstellung
Sulfenamide werden üblicherweise durch Reaktion von Sulfenylchloriden und Aminen dargestellt:
Die Bildung der S-N-Bindung erfolgt gemäß den üblichen Regeln für bimolekulare nukleophile Substitutionen, wobei der Amin-Stickstoff das nukleophile Zentrum darstellt. Die Bildung primärer Sulfenamide erfolgt durch Reaktion eines Sulfenylhalogenids mit Ammoniak. Primäre, sekundäre und tertiäre Amine bilden Sulfenamide durch Reaktion mit Thiolen, Disulfiden und Sulfenylthiocyanaten.[2] Beispielsweise reagieren Triphenylmethansulfenylchlorid und Butylamin in Benzol bei 25 °C:
Es sind zahlreiche weitere Reaktionswege bekannt. Eine metallorganische Variante verwendet Disulfide und Thiole als Edukte:[3]
Struktur
Die Struktur der Sulfenamide wurden mittels Röntgenstrukturanalytik charakterisiert. Die S-N-Bindung besitzt eine chirale Achse, die die Bildung von Diastereomeren bedingt. Dies wird durch das Vorliegen eines partiellen Doppelbindungscharakters erklärt, der durch das freie Elektronenpaar am Schwefel- bzw. Stickstoffatom und Besetzung eines antibindenden Orbitals am jeweils anderen Atom zustande kommt.[1]
Raumfüllende Substituenten und die Abstoßung der freien Elektronenpaare wirken der Rotation um die S-N-Bindung und damit der Interkonversion der Diastereomere weiter entgegen. Die Torsionbarrieren betragen zwischen 12 und 20 kcal/mol.[4]
Das Stickstoffatom bildet mit seinen Bindungspartnern üblicherweise eine pyramidale Struktur. Zyklische Substituenten und sterische Hinderung können zu einer planaren Struktur führen.
Reaktionen
Die S-N-Bindung ist auf viele Weisen instabil.[4] Das Schwefelatom ist tendenziell das elektrophilere Zentrum der S-N-Bindung. Ein nukleophiler Angriff auf den Schwefel kann durch Amine, Thiole und Alkyl-Magnesiumhalogenide erfolgen, was entweder zu neuen Sulfenamidverbindungen oder Sulfiden bzw. Disulfiden führt.[1]
Das Stickstoff- und Schwefelatom der S-N-Bindung verfügt jeweils über freie Elektronenpaare. Diese freien Elektronenpaare ermöglichen es die Bindungsordnung zu Substituenten zu erhöhen oder Bindungen zu weiteren Substituenten einzugehen. Beispielsweise kann der Stickstoff in der S-N-Bindung mit Natriumdichromat zu einer Imin-Spezies oxidiert werden.[4]
Sulfenamide reagieren mit Amino-Azaheterozyklen zu hetrozyklischen Systemen. Diese werden unter anderem als Amino-Schutzgruppe verwendet. Chlorocarbonylsulfenylchloride (ClCOSCl) bilden mit 2-Amino-Azaheterozyklen zyklische S-N-Bindungen.
Für Sulfenamide ist eine neue Variante der Appel-Reaktion bekannt: Reaktion von o-Nitrobenzolsulfonamid mit PPh3 und CCl4 führt zu o-Nitro-N-(triphenylphosphoridene)-benzolsulfenamid. Dabei bildet das Triphenylphosphin eine Doppelbindung zum Sulfenamid-Stickstoff aus, entgegen der in der Appel-Reaktion üblichen Sauerstoffbindung. In der herkömmlichen Variante der Appel-Reaktion wird die R-OH-Bindung gespalten und ein Sauerstoff verbleibt am Triphenylphosphin. In der Sulfenamid-Variante bleibt die S-N-Bindung erhalten.
Anwendungen
Sulfenamide wie Cyclohexylthiophthalimide werden in großen Mengen bei der Vulkanisierung von Gummi eingesetzt. Die Sulfenamide beschleunigen den Vulkanisierungsprozess durch Bildung transienter S-N-Bindungen. Die Substituenten an der Sulfenamid-Bindung bestimmen dabei den Zeitpunkt im Prozess zu dem die Spezies aktiv wird. Die temperaturabhängige Aktivierung der Sulfenamide ist wesentlich für den Vulkanisierungsprozess, da die Polymerisierungstemperatur die Kettenlänge und damit die Produkteigenschaften bestimmt.
Einzelnachweise
- G. Capozzi, G. Modena, L. Pasquato: Chemistry of sulphenyl halides and sulphenamides. In: Saul Patai (Hrsg.): Sulfenic Acids and Derivatives. John Wiley & Sons, Ltd, 1990, ISBN 978-0-470-77228-7, S. 403–516, doi:10.1002/9780470772287.ch10.
- Józef Drabowicz, Piotr Kiełbasiński, Marian Mikołajczyk: Synthesis of sulphenyl halides and sulphenamides. In: Saul Patai (Hrsg.): Sulfenic Acids and Derivatives. John Wiley & Sons, Ltd, 1990, ISBN 978-0-470-77228-7, S. 221–292, doi:10.1002/9780470772287.ch6.
- I. V. Koval’: Synthesis and application of sulfenamides. In: Russian Chemical Reviews. Band 65, Nr. 5, 1996, S. 421, doi:10.1070/RC1996v065n05ABEH000218.
- Leslie Craine, Morton Raban: The Chemistry of Sulfenamides. In: Chemical Reviews. 89, 1989, S. 669. doi:10.1021/cr00094a001.