Süßwasserpolypen
Süßwasserpolypen (Hydra) sind eine Gattung aus der Klasse der Hydrozoen (Hydrozoa), die zum Stamm der Nesseltiere (Cnidaria) gehören. Süßwasserpolypen werden je nach Art bis zu 3 cm groß und besiedeln Süß- und Fließgewässer, in Ausnahmefällen auch Brackwasser. Hydra ist – wenn man Chlorohydra nicht, wie es manche Autoren tun, als eigenständige Gattung zählt – die einzige Gattung innerhalb der Familie Hydridae.
| Süßwasserpolypen | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name der Familie | ||||||||||||
| Hydridae | ||||||||||||
| Dana, 1846 | ||||||||||||
| Wissenschaftlicher Name der Gattung | ||||||||||||
| Hydra | ||||||||||||
| Linnaeus, 1758 |
In Europa kommen mindestens 5 Arten der Gattung vor, darunter Hydra vulgaris (Gemeiner Süßwasserpolyp) und Hydra viridissima (auch Chlorohydra viridissima oder Grüne Hydra genannt; die grüne Färbung rührt von mit Hydra symbiontisch lebenden Chlorella-Algen her). Hydra findet sich bisweilen in Aquarien und wird oft erst dann bemerkt, wenn sie sich aufgrund erhöhten Nahrungsangebots heftig vermehrt.
Charakteristik
Die Vertreter der Gattung und Familie leben als solitäre Polypen; es werden keine Medusenstadien und auch keine Gonophoren, wie sie bei anderen Hydrozoen üblich sind, gebildet. Hydren besitzen einen Kranz hohler filiformer Tentakeln um den Mundkegel herum. Der untere Teil des Polypen weist eine Fußscheibe auf. Es kommt sexuelle und asexuelle Fortpflanzung vor. Die Geschlechtsprodukte entwickeln sich direkt in warzenartigen Vorsprüngen in der Epidermis des Polypen, die männlichen im oberen Teil des Polypen, die weiblichen im unteren Teil. Die ungeschlechtliche Fortpflanzung erfolgt durch Knospung, Längs- oder Querteilung. Befruchtete Eier können sich mit einer Schutzhülle umgeben und längere Zeit überdauern, bevor der kleine Polyp schlüpft. Es kommen vier Typen von Nesselzellen vor: Stenotelen, Desmonemen, atriche und holotriche Isorhizen.[1]
Körperbau

Die Körperwand des Süßwasserpolypen bzw. Hydra besteht aus drei Schichten: der „Außenhaut“ (ektodermale Epidermis), der „Innenhaut“ (Entodermale Gastrodermis) und einer gallertartigen Stützmatrix, der sogenannten Mesogloea, die abgesehen von Nervenzellen, zellfrei ist. Ektoderm und Entoderm werden jeweils von Zellen gebildet. Im Ektoderm finden sich Sinnes- oder Rezeptorzellen, die Umgebungsreize wie leichte Wasserströmungen oder chemische Reize aufnehmen und die Information über einen Fortsatz zu Nervenzellen in der Stützschicht weiterleiten.
Außerdem gibt es im Ektoderm Nesselkapseln (Cniden), die ausgeschleudert werden, ein lähmendes Gift freisetzen und so dem Fang von Beute dienen. Diese Nesselkapseln sind nicht regenerierbar, können also nur einmal ausgeschleudert werden. Sie werden von Nesselzellen (Cnidoblasten) gebildet, die ihrerseits aus sogenannten interstitiellen Zellen hervorgehen. Cnidoblasten und interstitielle Zellen haben gemeinsam, dass mehrere Einzelzellen über Interzellularbrücken verbunden sind. Bei Hydra treten Nesselkapseln gehäuft an den Tentakeln auf. An jeder dieser Tentakeln sitzen 2500 bis 3500 Nesselkapseln.
Den größten Anteil der Zellen des Ektoderms bilden jedoch Epithelmuskelzellen, die mit einem basalen Fortsatz, in dem sich Muskelfilamente befinden, an der Stützschicht befestigt sind. Die Epithelmuskelzellen bilden Längsmuskelschichten entlang des Polypenkörpers. Durch Anregung dieser Zellen kann sich der Polyp schnell zusammenziehen. Auch im Entoderm befinden sich Muskelzellen, diese werden aufgrund ihrer Funktion, der Aufnahme von Nährstoffen, Nährmuskelzellen genannt. Sie sind im Gegensatz zu den Muskelzellen des Ektoderms ringförmig angeordnet. Dies führt dazu, dass sich der Polyp streckt, wenn die Muskelzellen des Entoderms kontrahieren.
Die entodermale Gastrodermis umschließt einen Hohlraum, das sogenannte Gastrocoel oder Coelenteron. Da dieser Hohlraum sowohl Aufgaben eines Verdauungstraktes wie auch eines Gefäßsystems übernimmt, spricht man hierbei von einem Gastrovaskularsystem. Zu diesem Zweck gibt es neben den Nährmuskelzellen im Entoderm noch spezialisierte Drüsenzellen, die Verdauungssekrete ausscheiden.
Zusätzlich gibt es sowohl im Ektoderm als auch Entoderm Ersatzzellen, die sich in andere Zellen umwandeln können oder zum Beispiel Spermien und Eizellen produzieren (die meisten Polypen sind Zwitter).
Nervensystem
Die Hydra weist wie alle Hohltiere (Coelenteraten) ein Nervennetz auf. Es treten keine Koordinationszentren wie Ganglien oder ein Gehirn auf. Dennoch ist eine Häufung von Sinnes- und Nervenzellen und deren Fortsätzen an Mund und Stiel zu beobachten. Süßwasserpolypen reagieren auf chemische, mechanische und elektrische Reize, sowie auf Licht und Temperatur.
Nahrungsaufnahme und Verdauung
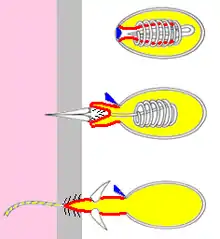
Die Nahrung der Süßwasserpolypen besteht aus kleinen Krebsen, Wasserflöhen, Larven von Insekten, Wassermilben, Plankton und anderen Kleintieren des Wassers. Sie werden mit Hilfe der Tentakel gefangen. Berührt ein Tierchen einen Tentakel, so bleibt es dort hängen und wird durch das Gift der herausgeschossenen Nesselkapseln gelähmt, evtl. auch getötet. Die Nesselkapseln tragen einen kleinen Fortsatz, bei dessen Berührung sich ein winziger Deckel öffnet; der Schlauch der Nesselkapsel schnellt heraus, durchdringt das Opfer und setzt sein Gift frei, wodurch es gelähmt wird. Der Vorgang des Herausschnellens dauert nur etwa 3 Mikrosekunden. Danach krümmen sich die Fangarme und bewegen so die Beute in Richtung Mundöffnung. Von dort gelangt sie in den Gastrovaskulartrakt des Polypen, wo sie von einem Sekret der Drüsenzellen verdaut und von Nährmuskelzellen aufgenommen wird (Endocytose). Unverdauliches wird schließlich durch die Mundöffnung wieder ausgeschieden.
Fortbewegung
Polypen können sich spannerraupenähnlich und per „Überschlag“ fortbewegen. Im ersten Fall wird der Rumpf zur Seite geneigt, bis das Mundfeld mit den Tentakeln den Boden berührt. Dort heften sie sich mit Hilfe von Glutinanten (ein Typ von Nesselkapseln mit Klebesekret) für kurze Zeit fest. Das untere Rumpfende wird daraufhin nachgezogen und der Körper erneut zur Seite ausgestreckt. Bei der Fortbewegung durch Überschlag heftet das Tier die Tentakeln ebenfalls am Boden an, bewegt aber den Rumpf von der einen Seite zur anderen und richtet sich wieder auf. Polypen wandern etwa 2 cm am Tag. Durch Bildung einer Gasblase an der Fußdrüse, die für Auftrieb sorgt, kann „Hydra“ sich im Wasser auch aufwärts bewegen.
Fortpflanzung und Lebenserwartung
Im Gegensatz zu den meisten anderen Nesseltieren fehlt Süßwasserpolypen die Medusengeneration, sie kommen nur in Form von Polypen vor und weisen keine Generationswechsel (Metagenese) auf. Hydren können sich sowohl ungeschlechtlich, in Form von Sprossung neuer Polypen am Stiel des Elternpolypen, durch Längs- und Querteilung als auch unter bestimmten Umständen geschlechtlich fortpflanzen. Diese Umstände sind noch nicht restlos geklärt, jedoch spielt Nahrungsmangel eine große Rolle. Die Tiere können männlich, weiblich oder auch zwittrig sein. Die geschlechtliche Fortpflanzung wird durch die Ausbildung von Geschlechtszellen in der Wand des Tieres eingeleitet. Dabei bilden sich charakteristische spermagefüllte Vorwölbungen („Hoden“) im oberen Drittel des Tieres und ein Ovarium mit einer großen Eizelle im unteren Drittel eines zwittrigen Tieres. Die Eier werden noch in der Epidermiswand befruchtet. Das befruchtete Ei wird entweder vom Tier aktiv an den Untergrund angeheftet oder sinkt passiv zu Boden. Es kann sich jedoch auch mit einer Peridermhülle umgeben und in dieser Form Monate überdauern. Es übersteht in dieser Form Austrocknen und Durchfrieren. Danach schlüpft ein kleiner Polyp aus der Peridermhülle.
Beim Polyp steigt das Sterberisiko nicht mit zunehmendem Alter. Unter idealen Rahmenbedingungen besitzt er eine Lebenserwartung von mehreren Jahrhunderten.[2]
Regeneration
Die Süßwasserpolypen besitzen eine bemerkenswerte Regenerationsfähigkeit. Statt beschädigte Zellen zu reparieren, werden diese ständig ersetzt, indem sich Stammzellen teilen und zum Teil differenzieren. Innerhalb von fünf Tagen erneuert sich ein Süßwasserpolyp praktisch vollständig. Die Fähigkeit, sogar Nervenzellen ersetzen zu können, gilt bisher als einzigartig im Tierreich. Es ist jedoch zu beachten, dass es sich bei den Nervenzellen der Süßwasserpolypen um sehr primitive Neuronentypen handelt. Einige Populationen, die längere Zeit unter Beobachtung standen, zeigten keine Anzeichen von Vergreisung. Unter konstant optimalen Umweltbedingungen ist das Alter eines Süßwasserpolypen womöglich nicht begrenzt.[3] 2012 haben Forscher der Christian-Albrechts-Universität zu Kiel (CAU) den 2010 in Hydra entdeckten Transkriptionsfaktor FOXO3 als kritischen Faktor bei der Regulation der Stammzellproliferation beschrieben. Ein Genprodukt, das auch in Wirbeltieren und beim Menschen vorkommt. Dies spricht dafür, dass Mechanismen, die die Langlebigkeit kontrollieren, evolutionär konserviert sind.[4]
Eine weitere besondere Eigenschaft der Süßwasserpolypen ist, dass ihre Zellen, wenn sie voneinander getrennt werden, wieder zueinander finden oder neue Polypen aus ihnen wachsen. Noch aus Einzelstücken von 1/200 der Masse eines erwachsenen Polypen kann ein neues Individuum heranwachsen. So kann sich beispielsweise ein Süßwasserpolyp, der durch ein Netz gedrückt wurde, wieder selbst zusammensetzen. Diese Eigenschaft ist von hohem Interesse für die Biotechnologie.
Forschungsgeschichte
Süßwasserpolypen wurden bereits 1702 erstmals wissenschaftlich beschrieben; sie werden seit 300 Jahren wissenschaftlich untersucht. Experimentelle Studien zwischen 1736 und 1744 gipfelten in der Entdeckung ungeschlechtlicher Reproduktion durch Knospung und der ersten Beschreibung von Regenerationsvorgängen bei einem Tier. So war es Abraham Trembley der sich hauptsächlich mit Süßwasserpolypen (Hydra) befasste.[5] Er war der erste, der Tiere nicht nur beobachtete und beschrieb, sondern gezielte Experimente durchführte. Deshalb kommt ihm nach Meinung einiger führender Köpfe der Rang eines Vaters der experimentellen Zoologie zu.
1909 konnte Ethel Browne Harvey zeigen, dass die Transplantation des Hypostoms von einem Süßwasserpolypen (Hydra) auf einen anderen im Wirtstier eine neue Körperachse induzieren kann. Sie nahm damit die 1924 von Hans Spemann und Hilde Mangold durchgeführten Experimente vorweg, die 1935 zur Verleihung des Nobelpreis für Physiologie oder Medizin für die Entdeckung des Spemann-Mangold-Organisators führte.[6]
Forscher der Christian-Albrechts-Universität in Kiel haben entdeckt, dass der Süsswasserpolyp Hydra magnipapillata ein Protein mit der Bezeichnung Hydramacin-1 bildet, das eine Reihe von Bakterien regelrecht verklumpen lässt und tötet.[7] Es gelang ihnen auch das zugehörige Gen zu isolieren, sodass sie das Protein in Reinform herstellen konnten. Dabei konnten sie feststellen, dass Hydramacin-1 schon in relativ geringer Dosierung Enterobakterien, Klebsiellen, Streptokokken und Yersinien abzutöten vermag. Allerdings war es gegen einige andere Keime, wie beispielsweise Staphylococcus aureus weniger wirksam.[8][9]
Das vollständige Genom von Hydra magnipapillata ist seit 2009 sequenziert.[10]
Süßwasserpolypen als Umweltindikatoren
Süßwasserpolypen vertragen nur geringe Konzentrationen von Schwermetallen, wie beispielsweise Cadmium, und anderen Schadstoffen in ihrer Umgebung, weshalb sie als Anzeiger für Gewässerverunreinigungen Verwendung finden.
Systematik
Die Familie Hydridae wird in der „World Hydrozoa Database“[11] in die Unterordnung Capitata der Anthomedusae gestellt. Jean Bouillon et al. (2006) stellen sie dagegen in eine Unterordnung Moerisiida Poche, 1914 (zusammen mit den Familien Boeromedusidae, Halimedusidae, Moerisiidae und Polyorchidae). Diese Stellung der Hydridae wird wiederum von Allen et al. (2004) aufgrund molekularbiologischer Daten entschieden abgelehnt. Diese Autoren vereinigen die Familie Hydridae mit Candelabridae, Corymorphidae und Tubulariidae in einem Taxon Aplanulata (ohne hierarchischen Rang). Insgesamt listen die Werke 33 Arten der Gattung „Hydra“. Manche Autoren stellen die Arten „hadleyi“ und „viridissima“ in eine eigene Gattung „Chlorohydra“ innerhalb der Familie der Hydridae.[12]
|
|
|
Belege
Literatur
- Jean Bouillon, Cinzia Gravili, Francesc Pagès, Josep-Maria Gili und Fernando Boero: An introduction to Hydrozoa. Mémoires du Muséum national d' Histoire naturelle, 194: 1-, Publications Scientifiques du Muséum, Paris 2006, ISBN 978-2-85653-580-6.
- Marymegan Daly, Mercer R. Brugler, Paulyn Cartwright, Allen G. Collin, Michael N. Dawson, Daphne G. Fautin, Scott C. France, Catherine S. McFadden, Dennis M. Opresko, Estefania Rodriguez, Sandra L. Romano & Joel L. Stake: The phylum Cnidaria: A review of phylogenetic patterns and diversity 300 years after Linnaeus. Zootaxa, 1668: 127–182, Wellington 2007 ISSN 1175-5326 Abstract – PDF.
- Allen G. Collins, Silke Winkelmann, Heike Hadrys und Bernd Schierwater: Phylogeny of Capitata (Cnidaria, Hydrozoa) and Corynidae (Capitata) in light of mitochondrial 16S rDNA data. Zoologica Scripta, 34: 91–99, 2004 doi:10.1111/j.1463-6409.2005.00172.x.
Volker Storch, Ulrich Welsch, Adolf Remane: Systematische Zoologie. 6. Auflage. Spektrum Akademischer Verlag, 2003, ISBN 3-8274-1112-2.
Online
Einzelnachweise
- Marianne Klug, Jakob Weber und Pierre Tardent: Hemolytic and toxic properties of Hydra attenuata nematocysts. Toxicon, 27(3): 325-339, Oxford 1989 doi:10.1016/0041-0101(89)90180-3
- Max-Planck-Gesellschaft: Ein Hauch von Unsterblichkeit, vom 8. Dezember 2015, geladen am 23. September 2016
- D. E. Martinez: Mortality patterns suggest lack of senescence in hydra. In: Exp Gerontol 33, 1998, S. 217–225. PMID 9615920
- FOCUS Online: "Ist das Geheimnis ewiger Jugend gelüftet?: Deutsche Forscher entdecken Unsterblichkeits-Gen" – http://www.focus.de/gesundheit/news/ist-das-geheimnis-ewiger-jugend-gelueftet-deutsche-forscher-entdecken-unsterblichkeits-gen-in-suesswassertierchen_aid_861836.html
- Abraham Trembley. The Embryo Project. Arizona State University
- Ethel Browne Harvey, the discoverer of the ‘organiser’ phenomenon who saw Nobel Prizes ‘raining’ around her (European Marine Biological Resource Centre)
- Sascha Jung: Die Aufklärung der Tertiärstruktur des antimikrobiellen Peptids Hydramacin-1 mit Hilfe der mehrdimensionalen heteronuklearen NMR-Spektroskopie und die Untersuchung seines Wirkmechanismus. Dissertation, Christian-Albrechts-Universität – Mathematisch-Naturwissenschaftlichen Fakultät, Kiel 2008 (PDF-Datei).
- Sascha Jung, Andrew J. Dingley, René Augustin et al.: Activity of a Protein from the Basal Metazoan Hydra. In: Journal of Biological Chemistry. Bd. 284, Nr. 3, S. 1896–905, doi:10.1074/jbc.M804713200 (Volltext online).
- Thomas C. G. Boscha, René Augustin, Friederike Anton-Erxleben et al.: Uncovering the evolutionary history of innate immunity: The simple metazoan Hydra uses epithelial cells for host defence.In: Developmental & Comparative Immunology. April 2009, Bd. 33, Nr. 4, S. 559–569, doi:10.1016/j.dci.2008.10.004.
- Jarrod A. Chapman et al.: The dynamic genome of Hydra. In: Nature. 25. März 2010, Nr. 464, S. 592–596 Letter, doi:10.1038/nature08830.
- Eintrag Hydridae bei ITIS
Weblinks
- Der Süßwasserpolyp (griechisch Hydra)
- World Register of Marine Species
- Das "Monster" Hydra sp. – selbst Herkules konnte es nicht allein bezwingen
- Beobachtung der Süßwasserpolypen
- "Entladung der Stenotelen bei Hydra attenuata (Cnidaria, Hydrozoa)" (1988) – Wissenschaftsfilm aus der Sammlung des Bundesinstituts für den Wissenschaftlichen Film (ÖWF) im Onlinearchiv der Österreichischen Mediathek
