Riley-Oxidation
Die Riley-Oxidation ist eine Namensreaktion der Organischen Chemie und benannt nach dem Chemiker Harry Lister Riley (1899–1986).[1] Sie ist eine selektive, schonende Oxidationsmethode von Ketonen und Alkenen, wobei das zur Carbonylgruppe oder C=C-Doppelbindung α-ständige Kohlenstoffatom mit dem hochgiftigen Selendioxid zum Aldehyd, Keton oder Alken oxidiert wird. Als Lösungsmittel kommen Dioxan, ein Gemisch aus Essigsäure und Essigsäureanhydrid oder Wasser in Frage.[2]
Reaktionsübersicht
- eine allylische Methylgruppe (bzw. Methylengruppe oder Methingruppe) kann durch die Riley-Oxidation zum Alkohol oxidiert werden, wenn ein Lösungsmittel verwendet wird.[3][4] Ein Keton oder Aldehyd entsteht, wenn in der Gasphase gearbeitet wird.[5]
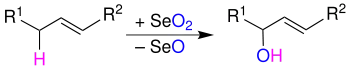
- eine α-ständige Methylgruppe (bzw. Methylengruppe) von Carbonylverbindungen kann mit Selendioxid zur 1,2-Dicarbonylverbindung oxidiert werden:[3][4]
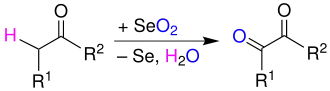
- 1,4-Diketone können mit Selendioxid zu ungesättigten 1,4-Diketonen oxidiert werden:[2]

Reaktionsmechanismus
In diesem Abschnitt werden die ersten beiden Mechanismen der Übersichtsreaktionen beschrieben.[3][4] Wird ein Alken 1 mit Selendioxid zur Reaktion gebracht, so erfolgt zunächst ein nucleophiler Angriff der Doppelbindung auf das Selen des Selendioxids. Dabei wird ein Proton übertragen. Dies kann als En-Reaktion klassifiziert werden. Nach einer [2,3]-Umlagerung entsteht dann die in Allylstellung oxidierte Zwischenstufe 3, die nach Abspaltung von Selenoxid den gewünschten Allylalkohol 4 liefert.

Wird das Keton 5 mit Selendioxid zur Reaktion gebracht, so ist auch hier der erste Reaktionsschritt durch einen nucleophilen Angriff auf das Selen des Selendioxids durch die Carbonylgruppe des Ketons bestimmt. Dabei wird ein Proton übertragen und nach weiteren Elektronenpaarumlagerungen das Keton 7 als Zwischenstufe erhalten. Im letzten Schritt wird elementares Selen und Wasser abgespalten, sodass die gewünschte 1,2-Dicarbonylverbindung 8 entsteht.

Vorteile und Nachteile
- Ein besonderer Vorteil der Reaktion ist das Ausbleiben der weiteren Oxidation von Aldehyden zu Carbonsäuren, was oft bei anderen Oxidationsmitteln zu beobachten ist.
- Die Reaktion verläuft sehr spezifisch für Oxoverbindungen und Alkene.
- Nachteilig ist die hohe Giftigkeit des verwendeten Selendioxids.
Einzelnachweise
- Harry Lister Riley, John Frederick Morley, Norman Alfred Child Friend: 255. Selenium dioxide, a new oxidising agent. Part I. Its reaction with aldehydes and ketones. In: Journal of the Chemical Society. 1932, S. 1875, doi:10.1039/jr9320001875.
- Dr. Thummel : Organic Synthesis & Reactions (Memento vom 14. Mai 2006 im Internet Archive), University of Houston.
- Zerong Wang: Comprehensive Organic Name Reactions and Reagents, Volume 3, Wiley Verlag, 2009, S. 2395, ISBN 978-0-471-70450-8, (3-Volume Set).
- László Kürti, Barbara Czakó: Strategic Applications of Named Reactions in Organic Synthesis; Elsevier Academic Press, Burlington-San Diego-London 2005, 1. Auflage; ISBN 0-12-369483-3.
- G. R. Waitkins, C. W. Clark, Chem. Rev. 1945, 36, S. 235–289.